【必看】一文了解免疫组化
免疫组化
免疫组化,是应用免疫学基本原理-抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对定量的研究,称为免疫组织化学技术或免疫细胞化学技术。
根据抗原抗体反应和化学显色原理,组织切片或细胞标本中的抗原先和一抗结合,再利用一抗与标记生物素、荧光素等的二抗进行反应,前者再用标记辣根过氧化物酶(HRP)或碱性磷酸酶(AKP)等的抗生物素(如链霉亲和素等)结合,最后通过呈色反应或荧光来显示细胞或组织中化学成分,在光学显微镜或荧光显微镜下可清晰看见细胞内发生的抗原抗体反应产物,从而能够在细胞爬片或组织切片上原位确定某些化学成分的分布和含量。
1、按照标记物的种类,如荧光染料、放射性同位素、酶(主要有辣根过氧化物酶和碱性磷酸酶)、铁蛋白、胶体金等,可分为免疫荧光法、免疫酶法、免疫铁蛋白法、免疫胶体金法及放射免疫自显影法等。
将已知抗体标上荧光素,以此作为探针检查细胞或组织内的相应抗原,在荧光显微镜下观察,当抗原抗体复合物中的荧光素受激发光的照射后会发出一定波长的荧光,从而可以确定组织中的抗原定位或定量。
基本原理是先以酶标记的抗体与组织或细胞作用,然后加入酶的底物,生成有色的不溶性产物或具有一定电子密度的颗粒,通过光镜或电镜,对细胞表面和细胞内的各种抗原成分进行定位研究。
免疫胶体金技术是以胶体金这样一种特殊的金属颗粒作为标记物。胶体金是指金的水溶胶,它能迅速而稳定地吸附蛋白,对蛋白的生物学活性则没有明显的影响。因此,用胶体金标记一抗、二抗或其他能特异性结合免疫球蛋白的分子(如葡萄球菌A蛋白)等作为探针,就能对组织或细胞内的抗原进行定性、定位,甚至定量研究。
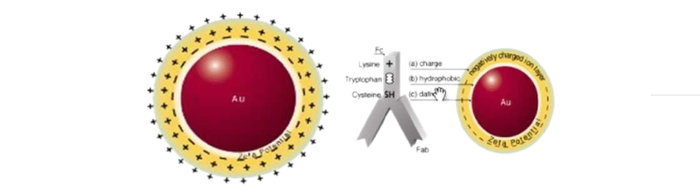
由于胶体金有不同大小的颗粒,且胶体金的电子密度高,所以免疫胶体金技术特别适合于免疫电镜的单标记或多标记定位研究。由于胶体金本身呈淡至深红色,因此也适合进行光镜观察。如应用银加强的免疫金银法则更便于光镜观察。
2、按染色步骤可分为直接法(又称一步法)和间接法(二步、三步或多步法)。与直接法相比,间接法的灵敏度提高了许多。
3、按结合方式可分为抗原-抗体结合,如过氧化物酶-抗过氧化物酶(PAP)法;亲和连接,如卵白素-生物素-过氧化物酶复合物(ABC)法、链霉菌抗生物素蛋白-过氧化物酶连结(SP)法等,其中SP法是比较常用的方法;聚合物链接,如即用型二步法,此方法尤其适合于内源性生物素含量高的组织抗原检测。
①免疫组化的原理就是一抗结合到目标蛋白,再有二抗来进行信号放大。
②二抗的信号放大有多种方法,取决于二抗标记方法的选择,简单的二抗标记方法是直接法,就是直接在二抗上标记酶,比如HRP,来进行显色,这样的二抗实际上很便宜,但是缺点就是灵敏度低,好多低丰度的蛋白,结合不上,免疫组化染出来的效果就不太好。
③第二种方法,叫做PAP,比如二抗标记了HRP,他们就在孵育二抗后,再孵育一种能结合HRP的一抗。这种方法灵敏度上去了,但是非特异性增高了。
④第三种方法被称为ABC法或者SABC法,主要是在二抗上标记生物素,孵育二抗后,加入亲和素以及标记了HRP的生物素,以这样的聚合方式,来进行信号的放大作用。这种方法的优点是能够成倍提高灵敏度,但同时也会提高非特异性,于是就产生了第四种方法,LSAB法标记的二抗:

这种方法,直接在亲和素上加上HRP标记,灵敏度也很高,同时降低了SABC法的非特异性。而且,LSAB法在实验的时一般孵育时间短(通常就10分钟)。
⑤SABC法和LSAB法在实验过程中需要进行内源生物素封闭,操作复杂些,于是产生了第五种标记方法,也就是Polymer法,就是在二抗上标记聚合的HRP:这样二抗的信号就得到了放大,灵敏度也提高了,但Polymer法、SABC法、LSAB法,都不能用于定量实验,只能用在IHC上。
免疫荧光主流是采用直接法、LSAB法,以及直接标记或者LSAB标记的三抗来进行信号放大的。总结一下,就是直接法的二抗便宜但是灵敏度差;PAP法基本已经淘汰,LSAB和SABC法的灵敏度高,但是贵,步骤多;Polymer法灵敏度高,步骤简单,但是贵。
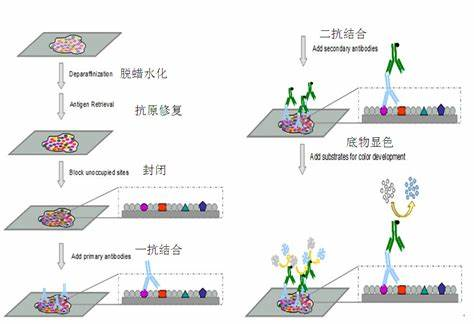
a.脱蜡:60℃ 20min;二甲苯I 10min 、二甲苯II 10min。
b.梯度水化:100%EtOH I 5min 、100%EtOH II 5min、95%EtOH 3min、80% EtOH 3min、70% EtOH 3min。
c.灭活内源性过氧化物酶:3%H₂O₂常温下避光孵育10min,PBS冲洗3次×3min。
d.抗原修复:置0.01M枸橼酸缓冲液(PH 6.0)中用煮沸(微波炉可高火4次×6min),自然冷却30min以上,至室温后PBS冲洗3次×3min。
e.封闭:用封闭液(一般与二抗来源一致,如正常羊血清工作液)封闭,常温下10~30min,倾去勿洗。
f.一抗孵育:滴加适宜浓度的一抗4℃冰箱孵育过夜(最常用),37℃复温45min,PBS冲洗5次×3min(用PBS缓冲液代替一抗作阴性对照)。
g.二抗孵育:滴加生物素标记二抗,37℃孵育30min, PBS冲洗5次×3min。
h.SP反应:滴加辣根过氧化物酶标记的链霉亲和素工作液,37℃孵育30min,PBS冲洗5次×3min。
i.DAB显色:配置DAB/H₂O₂反应液孵育组织切片,镜下控制染色,一般3~10min,自来水充分冲洗。
j.苏木素复染:一般胞浆蛋白或胞膜蛋白可以适当染至几十秒~几分钟,但细胞核蛋白在几秒。若过染,可以用1%HCl褪色。
k.常规脱水:50% ethanol 1-2min、70% ethanol 1-2min、95% ethanol 1-2min、95% ethanol 1-2min、100% absolute ethanol: (1-2)min、100% absolute ethanol: (1-2)min。
l.透明:Xylene 1×(1-2)min→Xylene 2×(1-2)min;
这是为了后面的抗体等试剂能够充分与组织中抗原等结合反应。脱蜡可以先60℃20min,然后立即二甲苯1-3分别10min(这个时间是由二甲苯新鲜程度和室温等综合决定的),但当天制好的切片一般先60℃ 3-4h。水化用梯度乙醇(由高到低)。若脱蜡和水化不全易出现局灶性反应和浸洗不全,而产生非特异性背景着色。
由于组织中部分抗原在甲醛或多聚甲醛固定过程中,发生了蛋白之间交联及醛基的封闭作用,从而失去抗原性;通过抗原修复,使得细胞内抗原决定簇重新暴露,提高抗原检测率。常用的修复方法从强到弱一般分为三种,高压修复、微波修复、胰酶修复。修复液也分为若干种(中性的、高pH的等)。
在传统的ABC法和SP法中,免疫组化反应结果容易收到内源性过氧化物酶和生物素的干扰,必须用过氧化氢和卵白素等进行灭活。灭活内源性过氧化物酶一般3%过氧化氢灭活时间短点,可以10min左右,而0.3%过氧化氢则可以适当延长封闭时间,一般10~30min。
用甲醇配置过氧化氢比双蒸水或PBS可能好在保护抗原和固定组织作用,过氧化氢孵育时间过长易引起脱片;现用现配,配好后4℃避光保存。
组织切片上有剩余的位点可以与一抗非特异性结合,造成后续结果的假阳性;封闭血清一般是和二抗同一来源的,血清中动物自身的抗体,预先能和组织中有交叉反应的位点发生结合;也可以用小牛血清、BSA、羊血清等,但不能与一抗来源一致。一般室温10-30min。但也要防止封闭过度。
一抗孵育条件在免疫组化反应中最重要,包括孵育时间、温度和抗体浓度。一抗孵育温度有几种:4℃、室温、37℃,其中4℃效果最佳;孵育时间:这与温度、抗体浓度有关,一般37℃1-2h,而4℃过夜和从冰箱拿出后37℃复温45min。
二抗孵育条件:二抗一般室温或37℃ 30min-1h,而浓度一般有工作液。抗体稀释液一般就用PBS即可,但专用的抗体稀释液中除PBS成份外,还加了叠氮化钠防腐剂、BSA稳定剂等组份,对抗体的多次回收利用较好。
为了防止一抗、二抗等试剂残留而引起非特异性染色,所以适当地加强清洗(延长时间和增多次数)尤为重要。
注意:a.单独冲洗,防止交叉反应造成污染。b.温柔冲洗(浸洗方式),防止切片的脱落。c.冲洗的时间要足够,才能彻底洗去结合的物质。d.PBS的PH和离子强度的使用和要求。建议PH在7.4-7.6浓度是0.01M。(中性及弱碱性条件(PH7-8)有利于免疫复合物的形成,而酸性条件则有利于分解;低离子强度有利于免疫复合物的形成,而高离子强度则有利于分解)。
背景的深浅和特异性染色的深浅均可以由DAB孵育条件决定。DAB显色时间不是固定的,主要由显微镜下控制显色时间,到出现特异性染色较强而本底着色较浅时即可冲洗;DAB显色时间很短(如几秒或几十秒)就出现很深的棕褐色,这很可能说明实验的抗体浓度过高或抗体孵育时间过长,需要下调抗体浓度或缩短实验的抗体孵育时间。
此外,若很短时间就出现背景很深,还有可能实验前面的封闭非特异性蛋白不全,需要延长封闭时间;DAB显色时间很长(如超过十几分钟)才出现阳性染色,一方面可能说明实验者的抗体浓度过低或孵育时间过短(最好一抗4℃过夜);另一方面就是封闭时间过长。
目的是形成细胞轮廓,从而更好地对目标蛋白进行定位,经常用苏木素复染(胞核染料)。注意苏木素复染时间要看当时的室温、溶液的新旧、目标抗原的定位等情况,一般数秒-数分钟,胞浆蛋白可以适当时间长一点,而胞核蛋白则要短。
不过这个如果染色不理想可以补救的。方法是:染色深则分化时间稍长些即可;染色浅则再置于苏木素中染色即可。盐酸酒精是分化,氨水是返蓝。作用不同。片子复染完后流水振洗,然后置于盐酸酒精中数秒(一定动作要快)后拿出流水振洗,在放入氨水中返兰即可。
免疫组化对标本处理最后的脱水透明需要采用由低至高的梯度酒精脱水,是避免直接将组织投入高浓度酒精中而造成组织过度收缩。
为了长期保存,实验人员一般用中性树胶等封片,避免产生气泡,方法是直接在载玻片组织上滴一滴封片液,然后一手拿住盖片某一拐角,而另一手拿对面的那个拐角,接近封片液近端的拐角先降低,直至接触到液体时为止;当发现液体接触面在不断弥散时,则可以缓慢降低另一拐角,这样一般不会产生气泡。
①抗体孵育时间过长、抗体浓度高易增加背景着色。这可通过缩短一抗/二抗孵育时间、稀释抗体来控制。
②一抗用多克隆抗体易出现非特异性着色,建议试用单克隆抗体。
③内源性过氧化物酶和生物素在肝脏、肾脏等组织含量很高(含血细胞多的组织),需要通过延长灭活时间和增加灭活剂浓度来降低背景染色。
④非特异性组分与抗体结合,这需要通过延长二抗来源的动物免疫血清封闭时间和适当增加浓度来加强封闭效果。
⑥PBS冲洗不充分,残留抗体结果增强着色,在一抗/二抗/SP孵育后的浸洗尤为重要。
⑦标本染色过程中经常出现干片,这容易增强非特异性着色。
①抗体浓度和质量问题以及抗体来源选择错误。不是抗体浓度越高就越易出现阳性结果,抗原抗体反应有前带和后带效应,必须摸索最佳浓度。
②抗原修复不全,对于甲醛固定的组织必须用充分抗原修复来打开抗原表位,以利于与抗体结合。
1、临床应用:恶性肿瘤的诊断与鉴别诊断;确定转移性恶性肿瘤的原发部位;对某类肿瘤进行进一步的病理分型。
2、免疫组化镜检:定位抗体的表达部位(细胞间质、细胞膜、细胞浆、核膜、细胞核等或表达组织)。
3、细胞凋亡检测:正常凋亡细胞通过检测凋亡细胞DNA片段进行染色,正常的、人为造成凋亡的细胞很少能够被染色。以甲基绿复染,便于从形态学上分辨评估正常细胞和凋亡细胞。

























加载更多