放射性药物-f区元素
近日,美国 劳伦斯伯克利国家实验室重元素化学(Lawrence Berkeley National Laboratory Heavy Element Chemistry)Alex Rigby & Trevor Arino,在Nature Reviews Chemistry上发表年度评述文章,讨论了2023年研究的亮点,以创新的方式利用f区元素,改变了治疗这些疾病的方式。

在过去的十年里,随着微创成像技术和放射性核素杀死癌细胞的特殊能力发展,放射性药物和放射生物学中,放射性f区元素的使用,已成为快速发展的领域。
为了将放射性核素递送到靶位点,研究人员已经开发了生物缀合物,由生物靶向载体、结合放射性核素的螯合剂和接头部分组成。具有与放射性核素的生物半衰期相匹配合适生物半衰期的靶向载体,决定了生物缀合物在体内的目的地。
理想情况下,在输送其有效载荷后,在对健康组织的任何损伤开始发生之前,它会迅速从体内排出。通常选择肽或抗体作为靶向载体,因为可与在癌细胞中过度表达的给定生物靶标相互作用,以确保将治疗递送到高度特异性的区域。螯合剂应与放射性核素形成惰性且坚固的复合物,以限制不需要的释放,螯合剂通过接头与靶向基团连接(图1)。
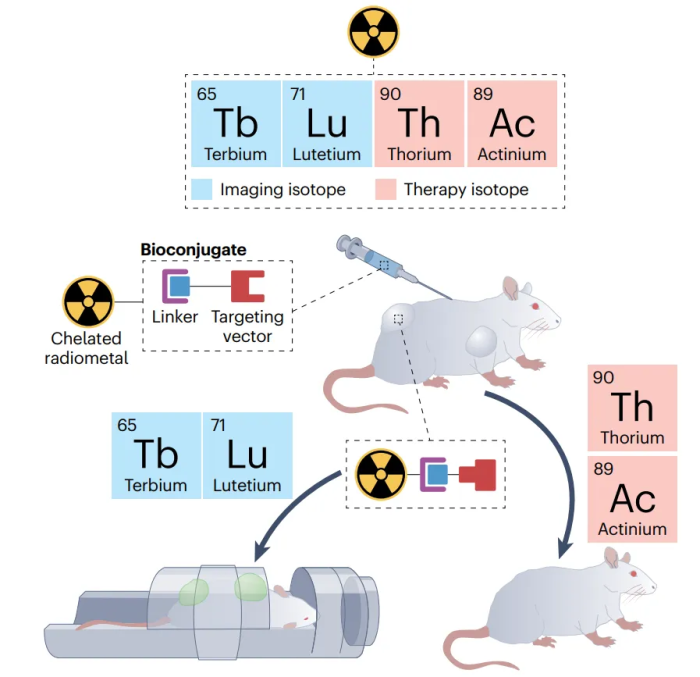
图1: 肿瘤小鼠模型中,典型的放射治疗方案(治疗+诊断=治疗)。
最后,根据放射性衰变途径(α、β或俄歇发射体)和放射性半衰期选择放射性核素。β粒子发射器,将用于杀死较大的肿瘤或细胞团,因为粒子可以移动更大的距离(0.1-10毫米)。α发射体用于较小的肿瘤,俄歇发射体用于单细胞或转移瘤,因为将能量沉积在小得多的面积上,传播距离较短(分别为40–80μm和几纳米)。
通常,f区元素具有非常长的半衰期(可能数千年)、复杂的电子结构和具有挑战性的放射化学性质,这限制了在核医学中的应用。尽管存在这些挑战,但同位素生产和分离方面的最新进展,使几种f区同位素用于靶向放射性核素治疗targeted radionuclide therapy (TRT)研究,其中几种在临床试验中,显示出了良好的前景,包括225Ac、227Th、177Lu和161Tb。
为此,该项研究,报道了过去一年中发表的这些研究进展,以彰显了最大限度地提高癌细胞杀伤潜力的创造性方法,以及用于治疗更晚期和侵袭性癌症的新的放射性递送方法。
今日新材料
展源
何发
热点文章
-
一文看懂测量不确定度
2024-09-04
-
各种缓冲溶液的配制方法大全
2024-10-15
-
超详细的紫外光谱,建议收藏!
2024-10-29
-
液相流动相,看完之后彻底明白了!
2024-10-17
-
GB/T 5750-2023《生活饮用水标准检验方法》系列标准
2024-09-02
-
【收藏】如何用ImageJ处理WB条带
2024-10-22
-
【标准解读】ISO14001:2015环境管理体系 要求及使用指南
2024-09-24
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来实验室媒体圆桌会成功举办
实验室是科技创新的基础条件和成果产出源泉。十四五以来,国家着力打造战略科技力量,推进国家实验室建设和国家重点实验室体系重组,数字化、智能化、自动化赋能生物科技快速发展,掀起了科研领域创新变革的浪潮。
作者:展源
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多