质粒纯化一定要注意这几点!
1
忽略质粒的拷贝数
同一大肠杆菌母株的质粒产量可能因多种因素而有很大差异。然而,质粒的复制起点将发挥重要作用,因为它将决定每个大肠杆菌细胞的质粒拷贝数 。因此,根据质粒的拷贝数,可能需要扩大质粒制备规模或进行多次质粒制备,以获得足够的质粒DNA供下游应用使用。
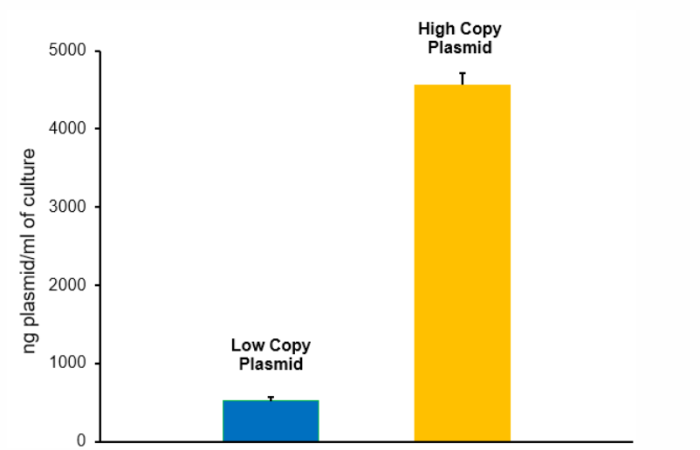
2
忘记在培养物中添加抗生素
如果您忘记在培养物中添加抗生素或添加太少,则可能导致质粒丢失。确保仔细检查培养物中抗生素的浓度。
3
忽略透气重要性
大肠杆菌培养物通常在瓶中生长,需要适当的通气才能实现最佳生长。通常需要以 200-250rpm的速度摇动培养物。此外,考虑通过最小培养物与空气体积比约为 1:5 来增加培养物通气,使用棉塞或透氧膜等确保培养物获得足够的通气。
4
过量培养
另一种情况是越多并不是越好,如果培养生长时间过长会导致基因组DNA污染。最好在接种后约 12-18 小时处理细胞。
5
测量OD600
OD600是估算培养物密度的好方法,以便您知道何时处理细胞。由于高光密度无法测量,因此取一份培养物,稀释十倍并使用标准分光光度计进行测量。培养物已准备好以0.2-0.35的OD600处理十倍稀释的培养物。
6
不要超出负载
许多质粒制备试剂盒都附带有关培养条件的建议。请仔细遵循这些步骤,以确保裂解纯化柱不会过载。添加过多的培养物肯定会降低裂解物的质量、堵塞纯化柱并降低纯化性能。
7
操作要清柔
正确纯化质粒的关键之一是将基因组DNA与质粒DNA分离。可以通过移液或涡旋将细菌沉淀重悬于P1缓冲液中。然而,在裂解过程中不能过度混合,因为您可能会剪切基因组DNA,而基因组DNA会与柱基质结合并污染您的质粒。
8
忽略裂解时间
有些人可能认为裂解时间越长越好,然而大肠杆菌的碱裂解时间过长会产生大量非质粒碎片。此外,不同菌株的大肠杆菌对碱裂解的敏感性也不同。最重要的是,裂解时间过长可能会导致质粒 DNA 变性,从而导致制备质量差。
9
完全中和裂解物
添加中和溶液并与裂解液混合后,不要立即进行下一步!中和不完全可能导致制备质量差。确保多次翻转试管以确保裂解物完全中和。即使观察到大的蓬松沉淀物,也需要多一点时间以确保溶液完全混合。
10
防止细胞碎片杂质
中和步骤后,许多质粒制备物需要离心以将 DNA 与细胞碎片分离,从而澄清裂解物。在此步骤中,重要的是要缓慢进行,并避免将不必要的细胞碎片转移到下一步,这可能会干扰结合和/或降低纯度。
11
记得添加酒精
许多质粒制备试剂盒包含使用乙醇的洗涤缓冲液。这些缓冲液通常为浓缩液,使用前必须用乙醇稀释。这是一个常见的错误,经常被遗忘并导致准备失败。另外,不要忘记确保拧紧盖子以防止乙醇蒸发。
12
P2加热缓冲液
一些缓冲液(P2 和结合缓冲液)可能在运输过程中沉淀。但是,不要尝试用微波加热缓冲液,请将缓冲液在30-37°C 下孵育最多10分钟,并通过翻转瓶子几次来混合。
13
忘记测纯度
下游转化问题的一个常见原因是盐和蛋白质的污染。确保每次纯化后测量A 260/A280和A260/A230比率,高于1.8的比率通常被认为是纯净且不含污染物的。
14
不要一次处理太多样品
虽然可以最大限度地提高时间效率,但质粒纯化中的某些步骤对时间敏感。不要尝试一次处理太多样本,否则某些准备工作可能会放置太久而失效。

15
不要忘记热洗脱
如果质粒>10 kb,请考虑使用加热至50°C的洗脱缓冲液,以提高从柱基质上洗脱的效率。此外,离心前可以将洗脱缓冲液留在柱上5-10分钟。
Super Lab
展源
何发
相关文章
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

质粒提取的小技巧,请收藏!
2020-05-27
-
红外光谱分析,你了解多少?
2021-01-11
-

三聚氰胺,你还要害多少人
2020-05-27
-

HPLC检测器,你了解吗?
2024-03-06
-

超净工作台原理,使用与维护
2020-05-27
-

选对色谱柱,快速开发方法
2020-05-27
-
检测有机氯类农药,气相色谱法检测法
2021-01-12

加载更多