抗体偶联药物治疗指数的讨论
在开发具有各种有效载荷、连接子和偶联方法的第一代ADC时,人们已经总结了一些关键的经验教训:
ADC通常被认为可以拓宽其有效载荷的治疗指数(TI),但临床数据表明,有效载荷和偶联药物的最大耐受剂量(MTD)(当剂量标准化后)相当。
ADC的MTD通常是由有效载荷介导的脱靶、非肿瘤毒性决定的,对于每种连接子-有效载荷类型都有其独特性。
在临床上,当选择在正常组织上低中表达水平的靶点时,ADC的靶向毒性可能会成为剂量限制性的,如TROP2、EpCAM、EphA2和其他靶点。它们的MTD通常决定于ADC的靶向、非肿瘤毒性。
一些ADC尝试条件性有效载荷释放,包括pH变化或蛋白酶活性,旨在使靶抗原结合或有效载荷释放取决于肿瘤环境特异性触发因素,尚未取得临床成功。
将马来酰亚胺己酰基(mc)连接子从ADC转移到人血清白蛋白的逆迈克尔反应,可能有助于ADC的抗肿瘤活性。
释放的循环有效载荷/毒素水平增加了ADC的平台毒性和抗肿瘤活性。
一般来说,与以等摩尔水平给药的相应小分子/毒素相比,ADC在临床和临床前都具有优异的抗肿瘤活性。
在最近Cancer Cell的一篇文章《The therapeutic window of antibody drug conjugates: A dogma in need of revision》中,作者全面地评价了ADC及其相应小分子毒素的MTD,发现了它们的MTD经过标准化之后并没有显著差异,因此质疑了ADC的历史假设,即它们增加了相应细胞毒性分子的MTD。然而,在临床试验中,ADC的确比其相应的化疗小分子具有更优越的抗肿瘤反应。这里,有人提出了一个修正的模型,其中ADC的抗肿瘤活性及其治疗指数不仅与它们的MTD的变化有关,而且与它们的最小有效剂量的变化也有关。此外,当使用基于暴露的TI计算方法时,可以更容易地解释ADC相对于其相应化疗小分子更优越的抗肿瘤活性。
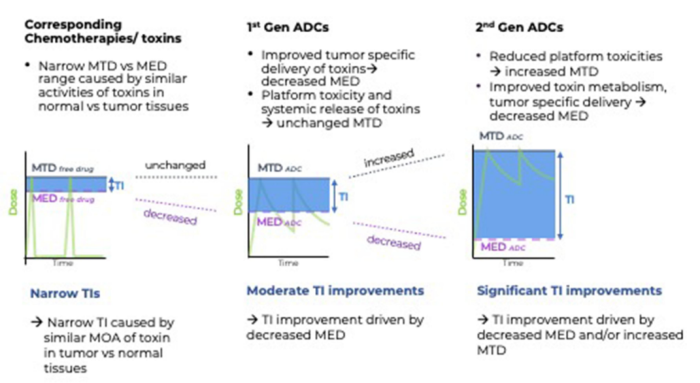
如上图所示,给予小分子化疗药物会导致更高的Cmax,清除迅速,消除半衰期短(几分钟到几小时)。ADC将有效载荷更具控制性和靶向性地递送到肿瘤,导致小分子药物的肿瘤暴露时间延长,呈现大分子的动力学,转化为MED减少。从概念上讲,如果不将更多相同的有效载荷输送到肿瘤中,就不能降低导致肿瘤细胞死亡的有效载荷的MED。与游离有效载荷相比,通过ADC增加的细胞毒性有效载荷的肿瘤特异性递送是其疗效提高的众多原因之一。
重要的是,第二代ADC对TI的改善,与第一代ADC相比,MTD增加和/或MED降低。第二代ADC的一个特点是位点特异性偶联,其中与抗体重链和轻链上精心选择的位点偶联导致几乎完全消除了主要平台毒性,即中性粒细胞减少症。当使用基于暴露的TI计算模型时,定点偶联与随机偶联相同的连接子-有效载荷相比,能够具有超过10倍的TI改善。例如PF-06804103与RC-48,它们具有非常相似的连接子-有效载荷,而从临床数据来看,定点偶联的PF-06804103初步ORR为54%,MTD>3 mg/kg;而随机偶联的ORR为30.8%,MTD为2.0 mg/kg。
当将小分子化疗药物与其相应的ADC进行比较时,了解两者之间暴露动力学的差异是很重要的。例如,细胞毒性药物的全身暴露量以分钟到小时为单位测量,而ADC的暴露量以天为单位测量。因此,对于半衰期为4至5 天的ADC,偶联毒素的全身暴露量远高于相应的小分子。
此外,小分子有效载荷在其较短的暴露时间窗口内优先分布在高度灌注的正常组织和肿瘤中,导致全身毒性,这通常需要在重复剂量周期内延长数周的恢复期,即“药物假期”。药物假期会降低抗癌药物的疗效,并可能导致耐药性。如果只关注ADC及其小分子细胞毒素之间的MTD,可能会忽略这两种模式之间的一些基本机制差异。而这些机制可能解释了它们的疗效和TI之间的差异。
因此,计算TI的基于暴露的模型更适合于解释两种模式之间的TI差异,也更适合于更好地理解ADC平台的改进,并为临床ADC候选者的选择提供参考。在该模型中,药代动力学和药效学(PK/PD)参数基于药物暴露水平随时间的变化,例如曲线下面积(AUC)和最大药物浓度(Cmax),而不是MTD或MED。此外,在基于暴露的TI计算模型中,由药物代谢酶的遗传多态性、外排泵、药物相互作用、靶抗原表达差异、体重、疾病或环境等因素引起的药物暴露的个体间差异也得到了更好的解释。
最后,不同的给药方案可以为相同的ADC产生不同的TI。例如,应用于急性髓系白血病(AML)患者的CD33靶向ADC Mylotarg的剂量分级方法,其以三个较小剂量给予相同的总剂量可显著改善总体反应并降低平台毒性,导致更高的TI值。这种分级的剂量方法改善了具有Cmax驱动毒性ADC的TI,这不能单纯用ADC剂量水平来解释。除了这种有效载荷介导的抗肿瘤活性外,抗体部分还可以通过激活免疫效应细胞,如ADCC、ADCP和CDC作用,提供额外的抗肿瘤活动。
总之,当应用基于暴露的TI计算方法时,ADC相对于其相应的小分子的优越抗肿瘤活性可以很容易地通过更高的肿瘤内毒素暴露水平来解释。这种基于暴露的TI计算方法将有助于指导未来几代ADC的工程设计,以进一步改善其TI,使更多的癌症患者获益。
参考文献:
1.The therapeutic window of antibody drug conjugates: A dogma in need of revision. Cancer Cell.2022 Oct 10;S1535-6108(22)00445-7
2.Therapeutic index improvement of antibody-drug conjugates. MAbs. 2023; 15(1): 2230618.
小药说药
展源
何发
热点文章
-
一文看懂测量不确定度
2024-09-04
-
各种缓冲溶液的配制方法大全
2024-10-15
-
超详细的紫外光谱,建议收藏!
2024-10-29
-
液相流动相,看完之后彻底明白了!
2024-10-17
-
GB/T 5750-2023《生活饮用水标准检验方法》系列标准
2024-09-02
-
【收藏】如何用ImageJ处理WB条带
2024-10-22
-
【标准解读】ISO14001:2015环境管理体系 要求及使用指南
2024-09-24
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来实验室媒体圆桌会成功举办
实验室是科技创新的基础条件和成果产出源泉。十四五以来,国家着力打造战略科技力量,推进国家实验室建设和国家重点实验室体系重组,数字化、智能化、自动化赋能生物科技快速发展,掀起了科研领域创新变革的浪潮。
作者:展源
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多