我们经常看到一些企业自检,就是GMP正文及相关附录作成表格,然后逐条核对,检查是否符合要求,例如:
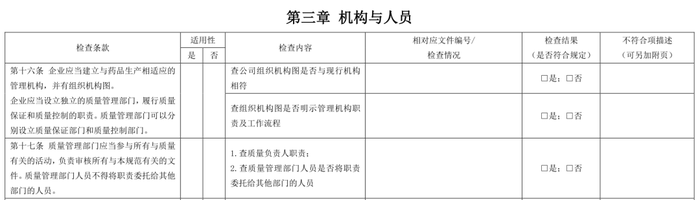
个人认为,这样的自检没有太大意义,基本上不能帮助企业提升,特别是老的、体系已经基本完善的企业,已有GMP条款上的内容肯定都已经落实,不可能有遗漏。
何况所谓药品GMP也不仅仅是正文和附录,所有涉药法律法规、GMP规范、法定标准等,都是企业必须遵守的规范,指导原则在很大程度上又是对法规规范的进一步解释说明,核对条款那根本就是核对不过来的,特别是那些销售对象包括欧洲、美国、日本等多个市场的企业,工作量就更大。
何况对于英美法系国家,案例本身就是法律的一部分,可以作为后续判案的基础,更是没法核对。故而他们的GMP习惯上称之为cGMP。
所以,有效的自检应该是基于风险的、有针对性的开展。
自检最基本的目的,毫无疑问是通过各种检查,包括官方的注册现场检查/批准前检查、常规检查、有因检查和客户审计。为了防止在这些检查中被发现重大缺陷,尽量减少缺陷,自检的范围就至少应该涵盖以上检查范围。
中国国家药品监督管理局2021年5月24日颁布的《药品检查管理办法(试行)》第三条规定,“本办法所指药品检查是药品监督管理部门对药品生产、经营、使用环节相关单位遵守法律法规、执行相关质量管理规范和药品标准等情况进行检查的行为。”
《药品生产监督管理办法》第三条规定,“原料药生产企业应当按照核准的生产工艺组织生产,严格遵守药品生产质量管理规范,确保生产过程持续符合法定要求。”
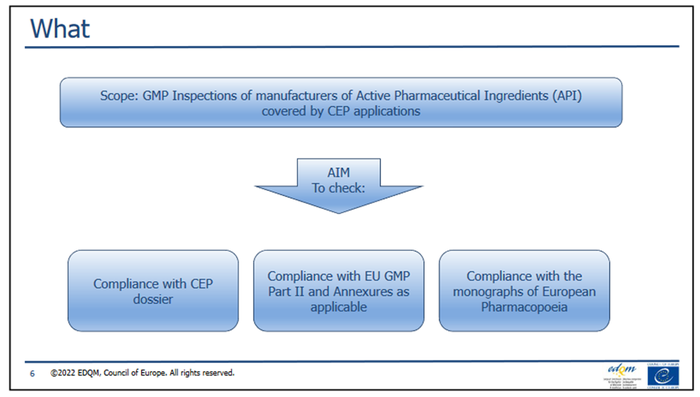
EDQM在其2022年8月的Presentation-Introduction to the EDQM inspection programme培训课件上再次强调,检查范围包括与所提交的CEP资料的一致性、EU GMP第二部分及其所有适用附件的符合性,及与欧洲药典的总体符合性。
2022年12月15日美国FDA给印度太阳药业的警告信中指出,该企业不仅违反了GMP规范(parts 210和211),还不符合美国药典要求,而良好的作法可以参见某某指导原则。
以上证据说明,企业质量自检需要涵盖的范围不能仅局限于GMP正文和附录,而应该涵盖所有涉药法律法规、GMP规范、药典等法定标准、注册申报文件等,指导原则属于法规规范的进一步解释说明。
更进一步,企业生存环境是不断变化的,法律法规、GMP规范、药典标准、客户和客户要求以及企业产品都是不断变化的,自检应该帮助企业了解自身对这些变化的适应能力,从而不断提高自身的生存状态。
1、相对于企业自身而言,外部检查主体(官方、第三方和客户等)对被检查客体是陌生的,所以其检查在其检查范围内内容更为宽泛,如企业关键人员的资质已经被内外部检查检查过N次,不可能存在兼职、学历和/或不够等缺陷,如果存在这种情况,企业在招聘的时候就会发现,官方和客户检查也早就发现了,企业自检完全没有意义,但外部检查的检查官对此并不清楚,所以很可能需要核查;
同样,企业色谱网络系统是不是有审计追踪,审计追踪是不是开启,企业无法关闭,企业自己肯定清楚,外部检查的检查官对此不清楚。
2、除非是专项自检,外部检查通常目的性更强,如注册现场核查/批准前检查、常规检查、有因检查,往往都带有特种目的,而内部全面自检,往往不能这么分,否则企业岂不是要1年进行N次全面自检?特别是产品需要销售到很多不同国家和地区的情况。
所以,企业要作一次全面自检的话,通常会针对目标市场各个国家、各个产品的所有法律法规、GMP规范、质量标准和注册承诺进行全面核对。
正因为企业内部全面自检同外部自检存在以上差异,所以内部自检的检查范围更宽,需要同时判断企业应对各个市场药政部门各类自检(批准前检查/注册现场核查、常规检查)、所有客户审计的能力,确保企业具备应对不断变化的生存环境的能力,实现为企业发展战略服务的目的。
当然,企业也不排除为了某种特殊目的有针对性的自检,如在美国FDA进行批准前现场检查前,针对所检查品种进行自检,将重点放在DMF与现场文件的一致性等方面。
有鉴于此,企业自检应当基于质量风险管理的原则,有针对的开展工作。
个人认为基于质量风险管理原则的自检,需要特别注意的风险应该包括:
1、药政法规的变化,包括药典变化。如针对校准模块,需要关注目标市场GMP规范的变更,以及计量法、计量法实施细则、实施强制管理的计量器具目录,和相关指导原则变化,可能导致企业内部管理文件和实践未及时跟上的风险。
2、变更,包括质量变更、关键人员等非质量变更,可能导致的质量风险。如生产线上增加了新产品,需要特别关注共线生产的风险,包括研发生产活动。新员工在上岗前时可能会关注其受教育背景、经验和培训等情况,但实际工作表现却需要一段时间的跟踪才知道。
新增一个法规市场,企业可能对新法规市场药政法规不熟悉,有些当地的药政法规要求没有内化到公司管理文件中。
3、外部审计缺陷、客户投诉、偏差、OOS、CAPA、年回发现的异常情况和异常趋势等,虽然在关闭这些活动时肯定会关注其对产品质量和质量体系的影响,但长期影响很可能会被忽视。如客户审计认为企业某项作法不太合理,企业根据客户意见改了之后客户感到满意,实际运行一段时间后发现变更后的作法会衍生出新的质量风险,风险大于收益。
4、新的注册申报、新的对外承诺(如质量保证协议、质量协议)落实情况。如质量保证协议中承诺通知客户的变更范围交公司内部常规的通知范围更大,企业有可能遗漏该承诺。
5、其他会随着时间变化而可能发生变化的要素,如设备老化所导致的一系列活动。
总之,基于风险的自检,不可能胡子眉毛一把抓,必须有针对的分配自检资源,重点关注可能存在风险的活动,减少在低风险领域的投入。
















评论
加载更多