指示剂分类、原理用量以及配制!

指示剂分类
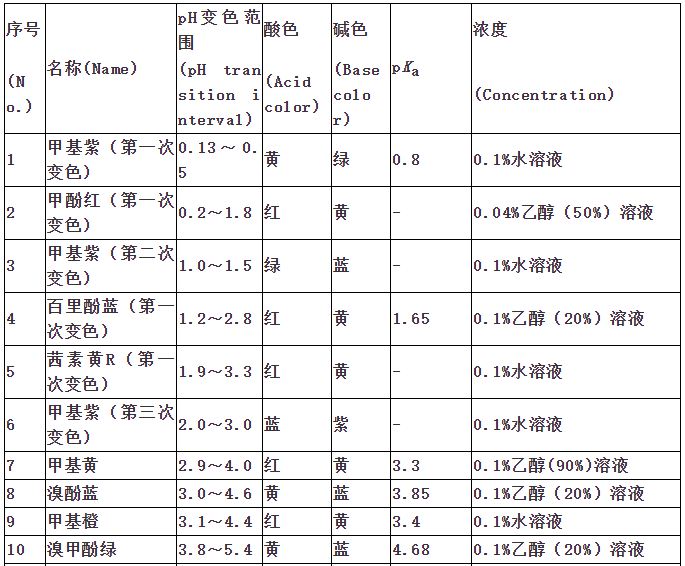
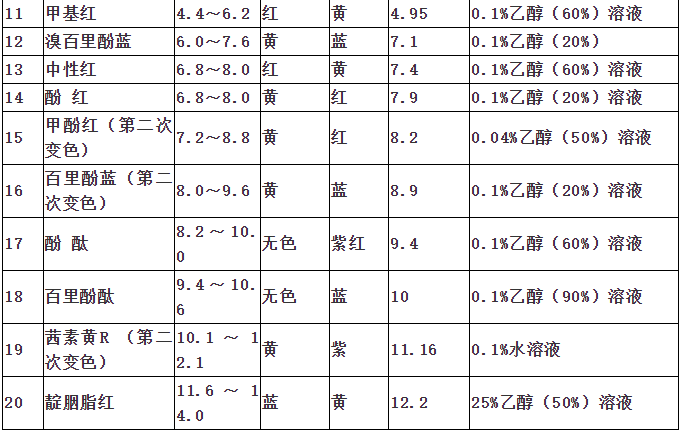
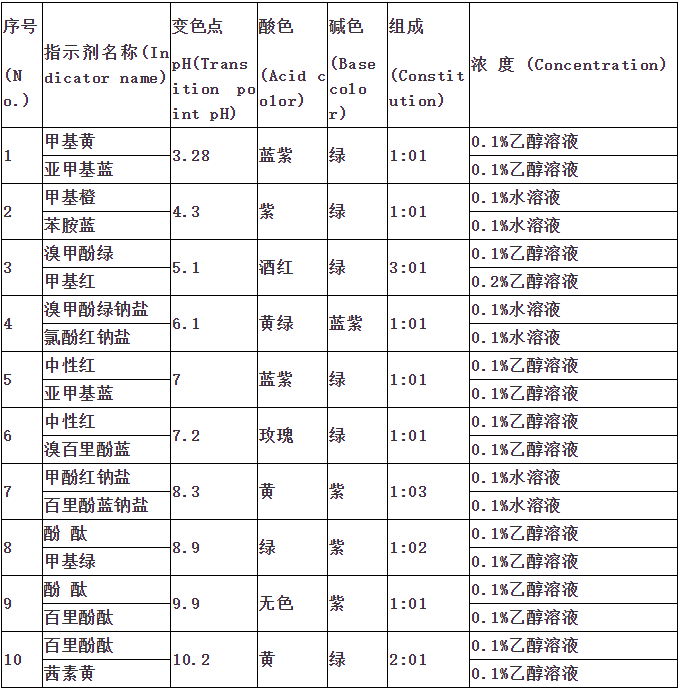
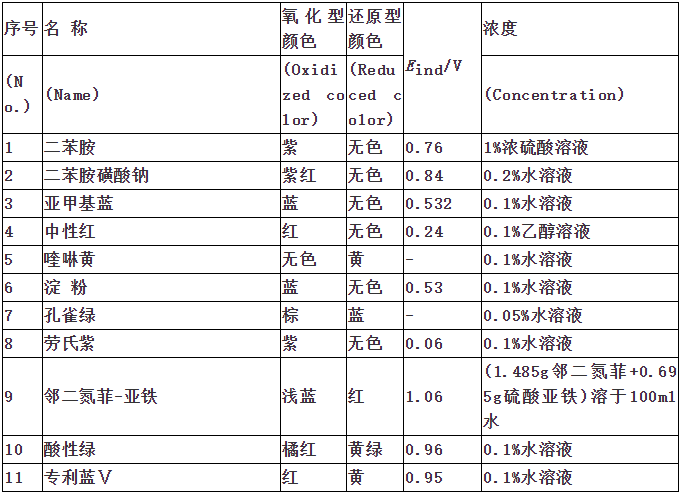
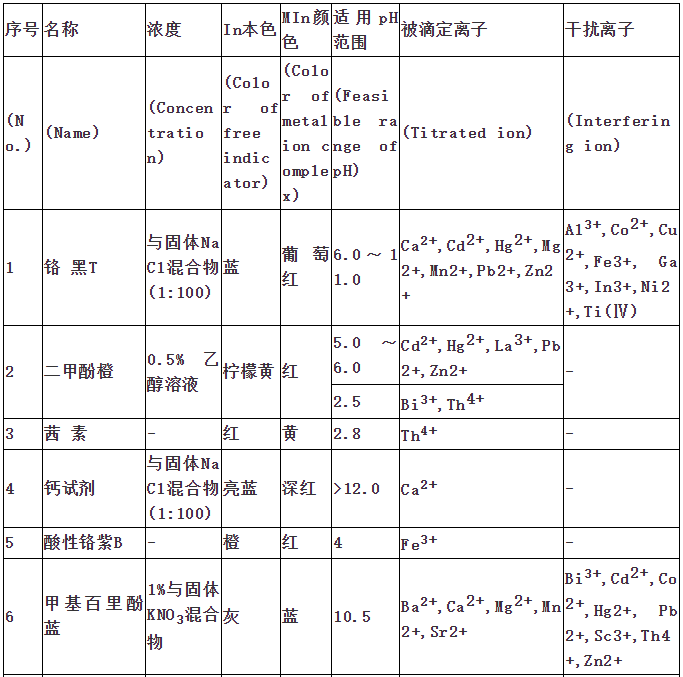
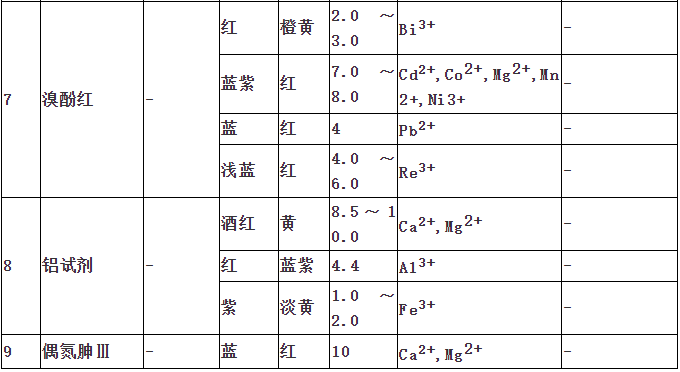
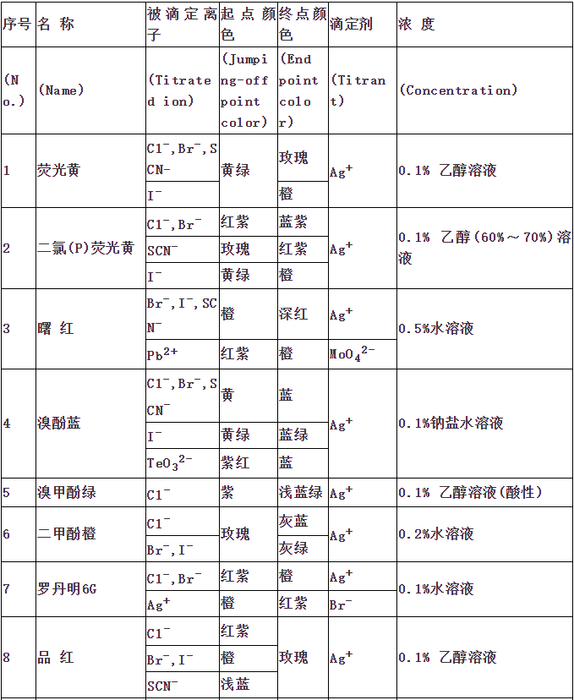
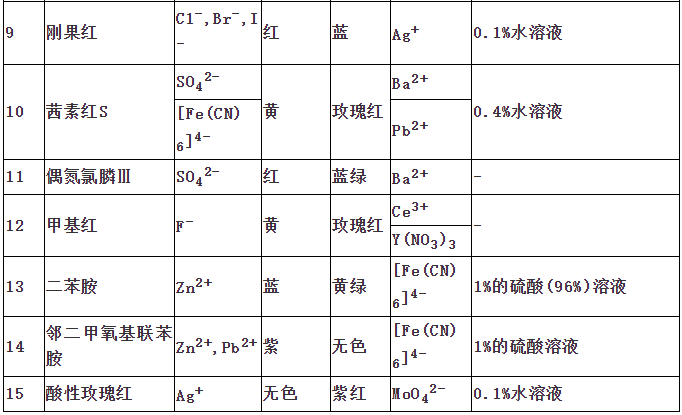
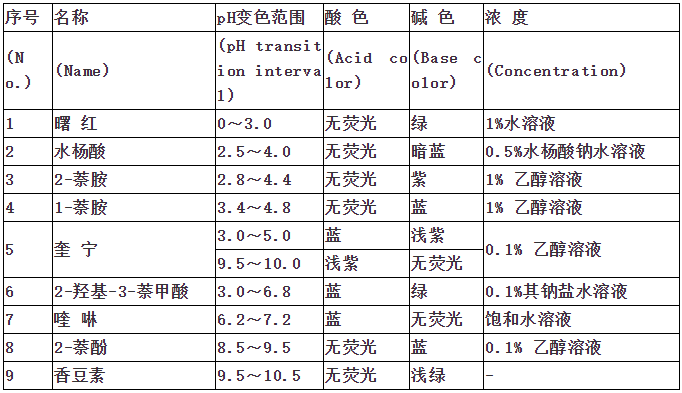
指示剂作用原理
指示剂的用量问题
展源
何发
相关文章
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

三聚氰胺,你还要害多少人
2020-05-27
-

红外光谱分析,你了解多少?
2021-01-11
-

选对色谱柱,快速开发方法
2020-05-27
-

HPLC检测器,你了解吗?
2024-03-06
-

超净工作台原理,使用与维护
2020-05-27
-

塑化剂躲不开 如何避免塑化剂危害
2020-05-27
-

食品添加剂及食品添加剂新品种相关法规汇总
2021-05-23
-

塑化剂检测方案
2020-05-27

加载更多