紫外吸收光谱原理与紫外分光光度计
紫外吸收光谱
01
有机化合物的紫外吸收光谱,取决于分子中外层电子的性质。有机化合物分子中通常有三类电子:σ电子、π电子、n电子 。
即形成单键的σ电子、形成不饱和键的π电子以及未参与成键的n电子(孤对电子)。处于基态的分子在吸收一定波长的光后,分子中的成键电子和非键电子可被激发跃迁至σ*和π*反键轨道。
有机化合物的紫外一可见吸收光谱,是其分子中外层价电子跃迁的结果。
其跃迁类型有σ→σ*、n→σ*、π→π*和n→π*四种,其相对能量大小次序为:
σ→σ* > n→σ* ≥ π→π* > n→π*
有机物最有用的吸收光谱是基于n→π*和π→π*跃迁而产生。
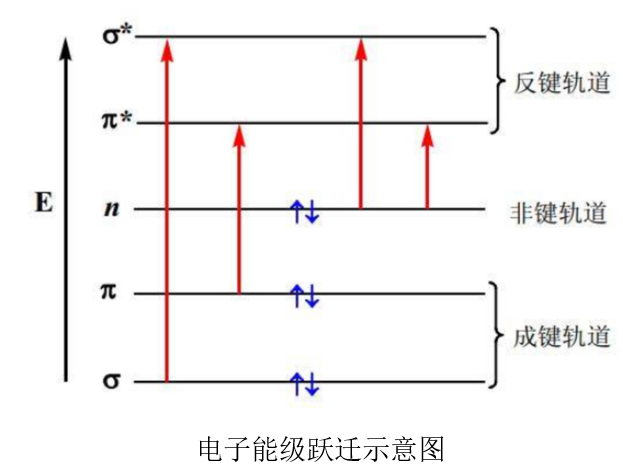
(1)σ→σ*跃迁
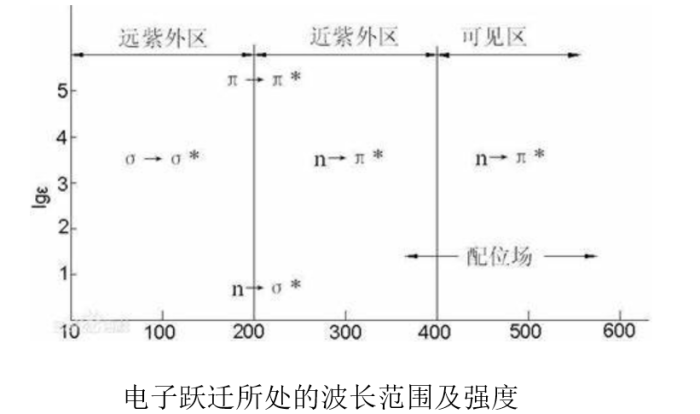
所需能量最大,σ电子只有吸收远紫外光的能量才能发生跃迁。饱和烷烃的分子吸收光谱出现在远紫外区(吸收波长λ<200nm,只能被真空紫外分光光度计检测到)。如甲烷的λmax为125nm,乙烷λmax为135nm。
(2) n→σ*跃迁
所需能量较大。吸收波长为150~250nm,大部分在远紫外区,近紫外区仍不易观察到。含非键电子的饱和烃衍生物(含N、O、S和卤素等杂原子)均呈现n→σ*跃迁。如一氯甲烷、甲醇、三甲基胺n→σ*跃迁的λmax分别为173nm、183nm和227nm。
(3) π→π*跃迁
所需能量较小, 吸收波长处于远紫外区的近紫外端或近紫外区,摩尔吸光系数εmax一般在104L•mol-1•cm-1以上,
属于强吸收。不饱和烃、共轭烯烃和芳香烃类均可发生该类跃迁。如乙烯π→π*跃迁的λmax为162nm。
(4) n→π*跃迁
所需能量最低,吸收波长>200nm。这类跃迁在跃迁选律上属于禁阻跃迁,摩尔吸光系数一般为10~100L•mol-1•cm-1 L,
吸收谱带强度较弱。分子中孤对电子和π键同时存在时发生n→π*跃迁。丙酮n→π*跃迁的λmax为275nm。
常见术语
02
(1)生色团
在紫外和可见光区产生吸收带的基团称为生色团。因为只有由π→ π*和n→π*跃迁才能产生紫外可见吸收,而这两种跃迁均要求有机物分子中含有不饱和基团,所以这类含有π键的不饱和基团称为生色团。简单的生色团由双键或叁键体系组成,如乙烯基、羰基、亚硝基、偶氮基-N=N- 、乙炔基、腈基-C=N等。
(2)助色团
有一些含有n电子的基团(如-OH、-OR、-NH2、-NR2、-X等), 它们本身没有生色功能(不能吸收λ>200nm的光),但当它们与生色团相连时,就会发生n-π共轭作用,增强生色团的生色能力(吸收波长向长波方向移动,且吸收强度增加),这样的基团称为助色团。
如苯环的一个氢原子被一些基团取代后,苯环在254nm处的吸收带的最大吸收位置和强度就会改变。
(3)红移和蓝移
由于化合物结构变化(共轭、引入助色团取代基)或采用不同溶剂后吸收峰位置向长波方向的移动,叫红移(长移)。
吸收峰位置向短波方向移动,叫蓝移(紫移,短移)。
紫外分光光度计
工作原理
01
分子的紫外可见吸收光谱是由于分子中的某些基团吸收了紫外可见辐射光后,发生了电子能级跃迁而产生的吸收光谱。由于各种物质具有各自不同的分子、原子和不同的分子空间结构,其吸收光能量的情况也就不会相同,因此,每种物质就有其特有的、固定的吸收光谱曲线,可根据吸收光谱上的某些特征波长处的吸光度的高低判别或测定该物质的含量。
光学系统原理
02
由光源钨灯和氘灯发出的复合光经由步进电机控制带动反光镜M1,反射通过入射狭缝,并进入单色器中,光栅衍射出的单色光经准直镜M2调焦,会聚通过出射狭缝,光束到达斩光器时,一段时间内的光射成为参比光路,另一段时间内的光透射成为样品光路。最后两光交替地照射在检测器(光电倍增管)。
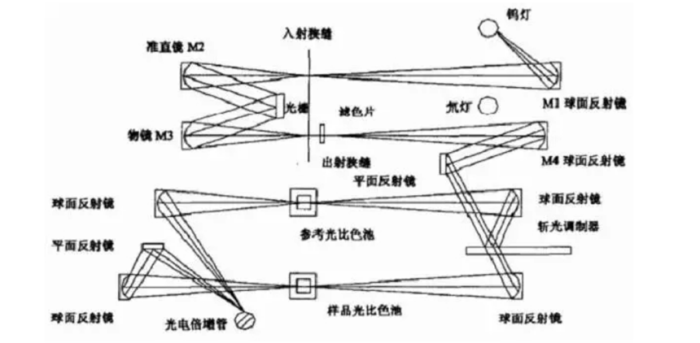
结构与功能
03
光源:光源钨丝灯和氘灯两种。可见光区(350~1000nm)使用钨丝灯;紫外光区则用氘灯。
吸收池:由于玻璃要吸收紫外线,因此盛溶液的吸收池用石英制成。
检测器:是将光信号转变为电信号的装置,测量吸光度时,并非直接测量透过吸收池的光强度,而是将光强度转换为电流信号进行测试,这种光电转换器件称为检测器。
信号显示系统:是将检测器输出的信号放大,并显示出来的装置。
特点
04
1. 灵敏度高。 2. 选择性好。
3. 准确度高。 4. 应用广泛。
5. 使用浓度范围广。 6. 分析成本低。
7. 操作简便。 8. 分析速度快。
分析与GMP
展源
何发
相关文章
-

超净工作台原理,使用与维护
2020-05-27
-

紫外杀菌原理及紫外灯结构和种类!
2020-05-27
-

紫外可见分光光度计的结构、原理与应用
2020-05-27
-

科学家研制出稳定且双折射可调的深紫外液晶光调制器
2022-11-09
-

紫外-可见分光光度法检测通过光催化降解的芳香标记物
2020-05-27
-

干货 | 紫外可见分光光度计的结构、原理与应用
2022-05-05
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

DNA定量法比较--紫外-可见吸收光谱和荧光光谱优势比拼
2021-02-02
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27

加载更多