流式细胞术中如何辨别死细胞?
流式细胞术中
流式样品中不可能完全去除死细胞,而在流式分析时又不希望有死细胞的干扰,所以如何在流式分析和流式分选时明确分辨死细胞就成为流式细胞术的一个重要研究内容。目前,有四种方法供流式分析者区分死细胞和活细胞。
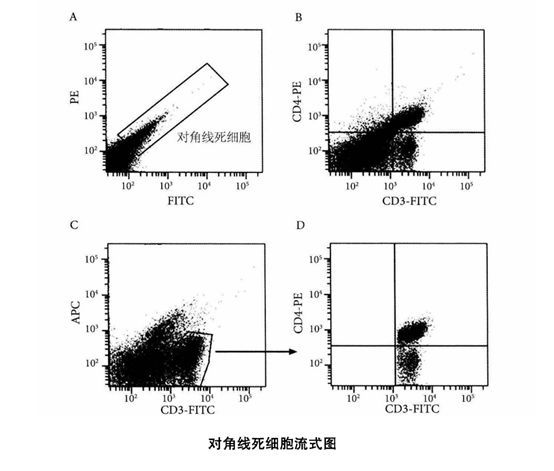
活细胞能产生非特异性荧光,只是非特异性荧光信号相对于荧光素发射的荧光信号较弱。死细胞也可以产生非特异性荧光,而且死细胞产生的非特异性荧光要明显强于活细胞,有的甚至强于荧光素产生的荧光信号。非特异性荧光产生的荧光波长没有选择性,并不是局限于某一荧光波长范围,而是处于连续的波长范围,所以一般所有的荧光通道都能够接收到死细胞产生的非特异性荧光信号,而且其在所有波长范围的荧光强度相差不多,各个荧光通道接收到的死细胞的荧光强度都是处于同一个等级的。在散点图上死细胞是位于对角线上的,而且不同的死细胞,其非特异性荧光的强度不同,且差异可能很大,强度大的可能是强度小的几十倍,甚至几百倍。所以从整体来看,死细胞的非特异性荧光强度呈现出从低到高的连续性分布,表现在散点图上死细胞刚好处于对角线上,如图A所示呈线型,与活细胞群体的圆形分布有明显区别。流式分析者可以根据死细胞的这一特点区分活细胞和死细胞。
死细胞位于散点图的对角线上
,但是对角线上的细胞却并不一定都是死细胞,因为双阳性细胞如果在x轴和y轴的荧光信号相似时,也可以位于对角线上。所以,散点图对角线上的细胞可能是死细胞,也可能是双阳性细胞,但是这两种细胞的形状是不一样的,死细胞呈现连续的线型分布,而双阳性细胞群呈现圆形的群体分布,可以从对角线上的细胞群体的形状大致判断细胞的性质。圆形的双阳性细胞群和线型的死细胞群有时相互重合在一起,这时依靠散点图无怯区分双阳性细胞和死细胞。如图B所示,样品细胞为正常小鼠脾脏细胞,标记FITC抗CD3抗体和PE抗CD4抗体,FITC和PE双阳性的CD4+T细胞与死细胞也在一起,无法区分。
如上所述,死细胞的非特异性荧光强度可以与荧光素产生的荧光强度类似,所以不能根据荧光强度的强弱去区分该荧光信号是来自于死细胞的非特异性荧光还是来自于荧光素产生的荧光,但是可以利用在散点图上死细胞位于对角线的特点来区分死细胞和阳性的活细胞。散点图可以同时反映两个荧光通道的信息,如果X轴代表的通道是标记的荧光素接收通道,而y轴代表的通道是不标记荧光素的通道,即闲置荧光通道,这时死细胞和X轴代表的荧光素阳性细胞在X轴的荧光信号可能相同,单从这个荧光通道信号无法区分,但是可以从散点图中细胞y轴信号的大小来区分,死细胞的X轴和y轴荧光信号相似,位于对角线上,而阳性细胞y轴代表的信号是阴性的,X轴代表的信号是阳性的,位于散点图的右下区域,即位于对角线死细胞的右下方,死细胞和阳性活细胞可以被明显区分。如图C所示,X轴表示FITC通道(样品细胞标记有FITC抗CD3抗体)、y轴表示APC通道(闲置通道),借用该散点图可以明确区分图B中无法区分的死细胞和双阳性细胞。此时只需将排除了死细胞后的CD3+T细胞设门,将门内的细胞显示于新的FITC-PE散点图中,如图D所示,此时该散点圈内的细胞都是活细胞,因为样品细胞同时标记有PE抗CD4抗体,所以图中的细胞明显分为两群,双阳性的是CD4+T细胞,单阳性的是CD8+T细胞。
7AAD(7氨基放线菌素D)
是一种经典的核酸标记染料,在流式细胞术中能够代替PI染料用于标记死细胞,以去除死细胞对于实验结果的影响。PI染料被激发后发射的荧光波长范围很大,常规FL1、FL2,FL3都能够接收到其荧光信号,所以与FITC和PE荧光素发射的荧光波长有很大程度的重叠,因此,PI染料不宜与FITC和PE共标记。而同样标记核酸的7AAD,其发射的荧光波长比较集中,一般被PerCP荧光通道接收,基本不与FITC和PE发射的荧光重叠,可以与FITC和PE共同标记样品细胞。所以,7AAD在标记死细胞方面要明显优于PI染料。
7AAD的荧光信号被PerCP通道接收,所以7AAD不能与PerCP或PE-Cy5偶联的抗体共同标记样品细胞。标记7AAD不需要与其他荧光素偶联抗体同时标记,只需在流式上样前5min加入适量的7AAD于流式管中,就可上样分析。分析时将PerCP通道阴性的细胞设门显示于新的流式图中即可,此时流式图中的细胞都是7AAD阴性的活细胞。
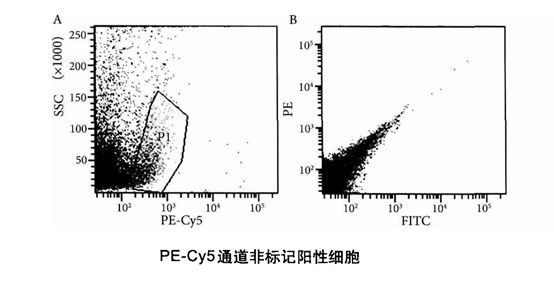
PE-Cy5通道(通常是FL3,接收的荧光波长范围大致为655-685nm)有时可用于识别死细胞,但首先该通道必须是闲置通道,即样品细胞中没有标记该通道代表的荧光素(PE-Cy5、PerCP等)偶联抗体。选择PE-Cy5-SSC散点图,一般可看到不成群的PE-Cy5阳性细胞,这些阳性细胞的SSC值也是散在分布的,这些散在的PE-Cy5通道非标记阳性细胞一般都是死细胞,如下图所示。PE-Cy5通道非标记阳性细胞,即图A中的设门部分,将这部分细胞设门显示于FITC-PE散点圈中,如图B所示,这部分PE-Cy5通道非标记阳性细胞基本都位于对角线部分,而对角线细胞一般就是死细胞,所以,散在的PE-Cy5通道非标记阳性细胞一般就是死细胞。
利用PE-Cy5通道非标记阳性细胞区分活细胞和死细胞时,流式图分析的顺序一般是先在FSC-SSC图中选择目标细胞所在的细胞群,将其设门,然后将门内的细胞显示于PE-Cy5-SSC散点圈中,排除PE-Cy5通道非标记阳性细胞代表的死细胞,将PE-Cy5阴性细胞设门,然后将门内的细胞显示于新的流式图内分析,这时该流式图内的细胞都是活细胞,分析或者分选时就可以尽量排除死细胞的干扰了。
但是,这种排除死细胞的方法只是一种经验方法,一般在实验要求不高或者预实验时使用,PE-Cy5通道非标记阳性细胞并不一定都是死细胞,死细胞也并不一定都位于PE-Cy5通道非标记阳性区域内,其阴性区域内也可能有一定比例的死细胞。所以,流式分析者可以借鉴这种方法区分死细胞和活细胞,但是不能将此方提作为区分死细胞和活细胞的金标准,7AAD标记法才是标记死细胞的金标准。
只标记分析活细胞的表面抗原分子时,用7AAD鉴别死细胞和活细胞是理想且经典的方法。但是如果分析胞内分子,如检测胞内的重要抗原分子、胞内细胞因子和胞内活化的激酶等都需要先固定样品细胞,然后用打孔剂在细胞膜上打孔,使荧光素偶联抗体能够通过细胞膜进入细胞内,与相应目标分子结合,这时7AAD就无怯鉴别死细胞和活细胞了。如果在固定细胞前标记7AAD,固定和打孔的过程可能会使7AAD发射荧光的能力丢失,如果在上样前标记7AAD,那所有的细胞都会被标记,因为7AAD也可经过小孔进入细胞内部与DNA结合。这时,就可以用EMA(ethidiummonoazaide)和胺反应性活性染料(aminereactiveviability dye,ViD)代替7AAD在分析胞内分子时用于鉴别死细胞和活细胞。
EMA与PI和7AAD一样也是一种能够与DNA结合的荧光染料,但不能自由通过活细胞的细胞膜,当细胞死亡细胞膜通透性增加时就可以进入细胞内与DNA结合。EMA比PI和7AAD稳定,标记胞内分子时的固定和打孔操作不会影响EMA发射荧光信号的能力,在固定前标记EMA就可排除死细胞的影响。但是,EMA只有暴露在紫外条件下才能够与DNA共价结合,而且EMA的荧光信号较弱。
ViD是一种新型鉴定活细胞和死细胞的荧光染料,它与EMA一样稳定,固定和打孔的操作不会影响其发射荧光的能力,在分析胞内分子时,固定前标记ViD可鉴别死细胞和活细胞,而且其标记过程简单,荧光信号也较强,具有较好的应用前景。
医学科研小坑
展源
何发










加载更多