get了这三大类电泳,实验再也不愁
电泳(electrophoresis)是带电物质在电场中向着与其电荷相反的电极移动的现象。各种生物大分子在一定的pH条件下,可以解离成带电荷的离子,在电场中会向相反的电极移动。在分析核酸、蛋白质等生物大分子时,电泳是一个非常有效的手段。含有电解液的凝胶在电场中,其中的电离子会发生移动,此时移动的速度可因电离子大小、形态及电荷量的不同而有差异。利用移动速度差异,就可以区别各种大小不同的分子。
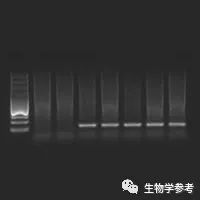
琼脂糖凝胶电泳是分子生物学实验室中分离鉴定核酸的常规方法。核酸是两性电解质,其等电点为pH2-2.5,在常规的电泳缓冲液中(pH约8.5),核酸分子带负电荷,在电场中向正极移动。线状双链DNA分子在一定浓度琼脂糖凝胶中的迁移速率与DNA分子量对数成反比,分子越大则所受阻力越大,也越难于在凝胶孔隙中移动,因而迁移得越慢。
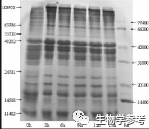
凝胶电泳技术用于分离不同物理性质(如大小、形状、等电点等)的分子。该技术操作简便快速,可以分辨用其它方法(如密度梯度离心法)所无法分离的DNA片段。在中学生物学习过程中,同学们常常感到与此有关的试题有一定的难度。
蛋白凝胶电泳(SDS-PAGE)原理
聚丙烯酰胺凝胶电泳简称为PAGE(Polyacrylamide gel electrophoresis),是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术。聚丙烯酰胺凝胶由单体丙烯酰胺和甲叉双丙烯酰胺聚合而成,聚合过程由自由基催化完成。催化聚合的常用方法有两种:化学聚合法和光聚合法。化学聚合以过硫酸铵(APS)为催化剂,以四甲基乙二胺(TEMED)为加速剂。
在聚合过程中,TEMED催化过硫酸铵产生自由基,后者引发丙烯酰胺单体聚合,同时甲叉双丙烯酰胺与丙烯酰胺链间产生甲叉键交联,从而形成三维网状结构。
PAGE根据其有无浓缩效应,分为连续系统和不连续系统两大类,连续系统电泳体系中缓冲液pH值及凝胶浓度相同,带电颗粒在电场作用下,主要靠电荷和分子筛效应。
不连续系统中由于缓冲液离子成分,pH,凝胶浓度及电位梯度的不连续性,带电颗粒在电场中泳动不仅有电荷效应,分子筛效应,还具有浓缩效应,因而其分离条带清晰度及分辨率均较前者佳。不连续体系由电极缓冲液、浓缩胶及分离胶所组成。
浓缩胶是由AP催化聚合而成的大孔胶,凝胶缓冲液为pH6.7的Tris-HCl。分离胶是由AP催化聚合而成的小孔胶,凝胶缓冲液为pH8.9 Tris-HCl。电极缓冲液是pH8.3 Tris-甘氨酸缓冲液。2种孔径的凝胶、2种缓冲体系、3种pH值使不连续体系形成了凝胶孔径、pH值、缓冲液离子成分的不连续性,这是样品浓缩的主要因素。
在聚丙烯酰胺凝胶系统中引进SDS, SDS能断裂分子内和分子间氢键,破坏蛋白质的二级和三级结构,因而蛋白质在一定浓度的含有强还原剂的SDS溶液中, 与SDS分子按比例结合,形成带负电荷的蛋白质复合物。SDS-PAGE一般采用的是不连续缓冲系统,即分为浓缩胶和分离胶。浓缩胶的作用是具有蛋白聚集浓缩作用,凝胶的浓度较小、孔径较大。不同蛋白在浓缩胶中的迁移速率一致,在电泳过程中不断被浓缩至一个狭窄的区带。当蛋白进入分离胶后,由于分离胶浓度较大、孔径较小,分子量小的蛋白由于体积较小,在凝胶中的迁移速率快,分子量大的蛋白迁移率慢,于是就造成不同分子量的蛋白便逐渐被分开。
毛细管电泳
毛细管电泳(Capillary Electrophoresis, CE),也可以称之为高效毛细管电泳(HPCE),是利用毛细管为被测物的分离场所,高压直流电场为被测物驱动力,根据样品间组分淌度和它们之间分配行为的不同,从而使其得到分离的一种液相分离技术,是将传统电泳技术与现代微柱分离技术结合起来,在20世纪80年代迅速发展起来的又一可以同气相色谱和高效液相色谱相提并论的分离分析技术。
仪器结构组成:高压电源、毛细管柱、缓冲液池、进样系统、检测器以及数据处理系统等。
分离原理:利用毛细管为被测物的分离场所,高压直流电场为被测物驱动力,根据样品间组分淌度和它们之间分配行为的不同,从而使其得到分离。
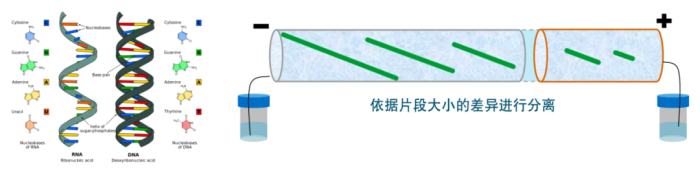
毛细管凝胶电泳法具有以下特点:
分辨率更高:按照核酸构型,可实现明显分离
定量更准确:无需照胶,利用积分方式准确定量
操作方便:无需制胶,省时省力
安全无毒:试剂使用量少,不涉及TB等有毒的核酸染料
展源
何发
相关文章
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-
红外光谱分析,你了解多少?
2021-01-11
-

HPLC检测器,你了解吗?
2024-03-06
-

三聚氰胺,你还要害多少人
2020-05-27
-

超净工作台原理,使用与维护
2020-05-27
-

选对色谱柱,快速开发方法
2020-05-27
-

二维凝胶电泳实验的纯水选择
2020-05-27
-
检测有机氯类农药,气相色谱法检测法
2021-01-12
-

'die','device','chip'有什么区别?
2024-02-21

加载更多