干货分享!细胞划痕实验新方法详解
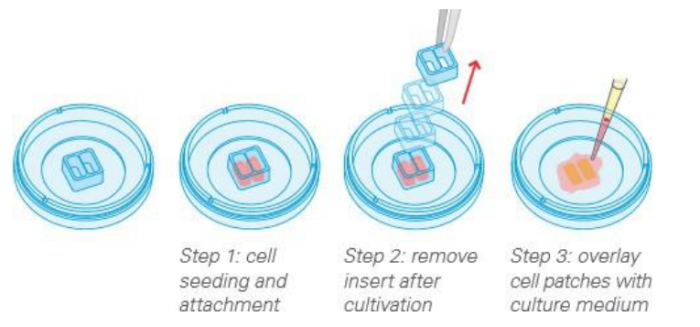
ibidi Culture-Insert 系列为伤口愈合实验提供了完整的解决方案,从样品制备到图像分析只需要几个步骤。本应用简报是使用 ibidiCulture-Insert 2 Well 分析 MCF-7 细胞迁移的详细方案。
-
细胞:MCF-7(ATCC:HTB-22;DSMZ:ACC115) -
同一实验耗材:2 孔插件放在 35 毫米的培养皿中,高壁(ibidi,80206) -
细胞培养表面:bidi ibitreat -
细胞培养基:RPMI(西格玛,R8758)=10% FCS(西格玛,F0804) -
细胞解离溶液:胰蛋白酶-ETDA(Sigma,59418C) -
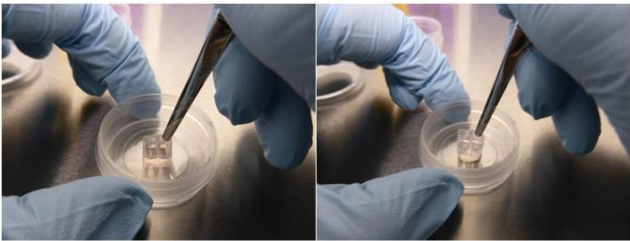
无菌镊子 -
倒置显微镜,最好具有自动图像采集系统和用于活细胞成像的顶部培养箱
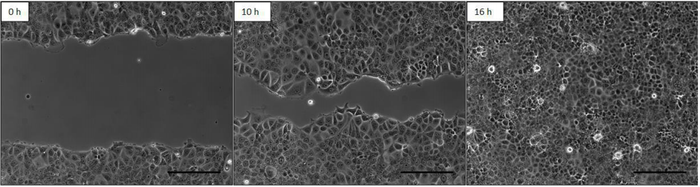
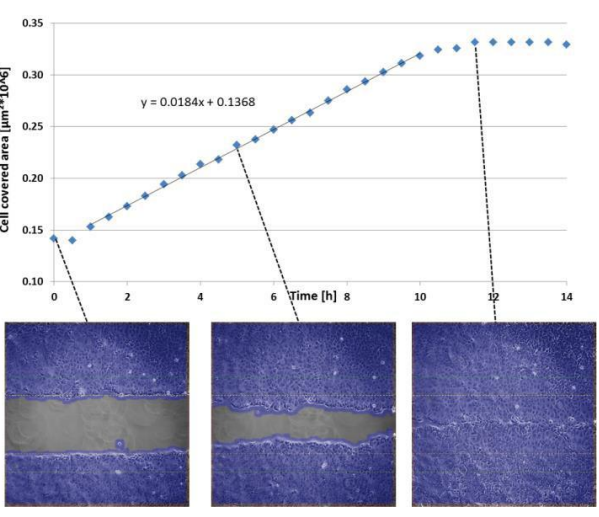
实验工作流程


展源
何发
相关文章
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

红外光谱分析,你了解多少?
2021-01-11
-

超净工作台原理,使用与维护
2020-05-27
-

HPLC检测器,你了解吗?
2024-03-06
-

三聚氰胺,你还要害多少人
2020-05-27
-

选对色谱柱,快速开发方法
2020-05-27
-

轻快,精确地移液——符合人体工程学设计的新型电子移液器
2020-05-27
-

轻快,精确地移液--符合人体工程学设计的新型电子移液器
2020-05-27
-
检测有机氯类农药,气相色谱法检测法
2021-01-12

加载更多