T 细胞活化实验干货,一文帮你梳理清楚
T 细胞的活化是研发 T 细胞相关疗法的基石。目前有多种已建立的体外刺激活化 T 细胞的方法,但实际过程中会发现同样的原理方法,其具体步骤中常常隐藏了很多的「套路」。在看过下面系统性的方法介绍,我终于摆脱了「套路」,不再被 T 细胞活化为难,一起看看吧。
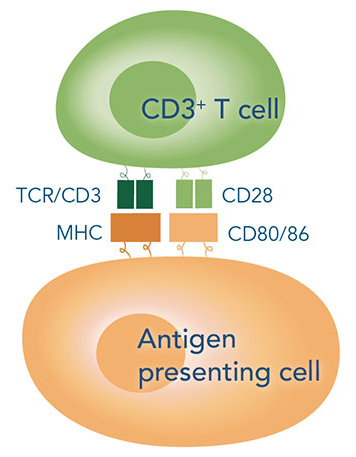
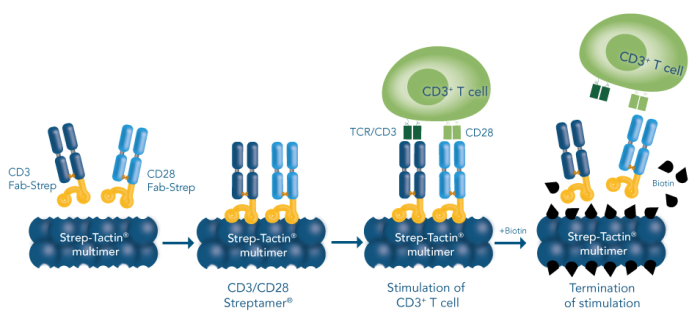
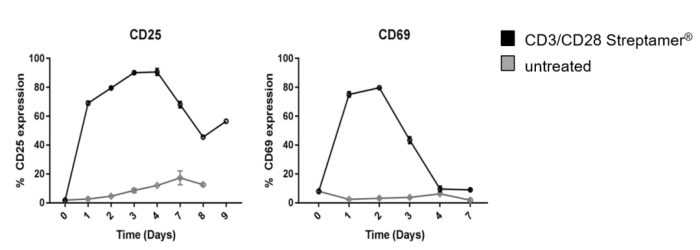
T 细胞的活化与增殖研究表明,诱导 T 细胞的活化与增殖需要两种信号:一种是 TCR / CD3 与抗原提呈细胞(APCs)表面特异的 MHCⅡ 抗原肽复合物结合产生的特异性抗原刺激信号;另一种是非特异性协同刺激信号,由 APCs 表面的协同刺激分子和 T 细胞的相应受体相互作用后产生,其中 CD28 / B7 是最为重要的协同刺激分子,能增加 IL-2 的产生,加速 T 细胞增殖,阻止细胞进入无反应状态或死亡。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(3)培养:培养过程中,每天观察细胞的状态,是否形成克隆团,或进行细胞计数,如果出现培养基变黄或细胞密度过高的情况,吹散细胞克隆团后调整细胞密度至 0.5~1 × 106/ml,更换培养板和培养基;

展源
何发
相关文章
-

细胞总乙酰化水平的快速测定方法
2021-01-11
-

选对色谱柱,快速开发方法
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

红外光谱分析,你了解多少?
2021-01-11
-

三聚氰胺,你还要害多少人
2020-05-27
-

HPLC检测器,你了解吗?
2024-03-06
-

超净工作台原理,使用与维护
2020-05-27
-

'die','device','chip'有什么区别?
2024-02-21

加载更多