GPCR抗体药物的研发进展
GPCR
GPCR(G Protein-Coupled Receptor),即G蛋白偶联受体,是哺乳动物基因组中最大的膜蛋白家族,广泛分布于中枢神经系统、免疫系统、心血管、视网膜等器官和组织,参与机体的发育和正常的功能行使。而如果与其相关的细胞内通路调节发生异常,或者外源病原物以之为受体攻击机体细胞,则会导致一系列疾病的发生。
由于GPCR在人体内表达的的广泛性和重要性,甚至在发现配体之前就已成为重要的药物靶标。GPCR近年来一直备受制药公司的青睐,截至2016年,共有1286种药物获得了FDA的批准,其中460种药物(36%)靶向GPCR。
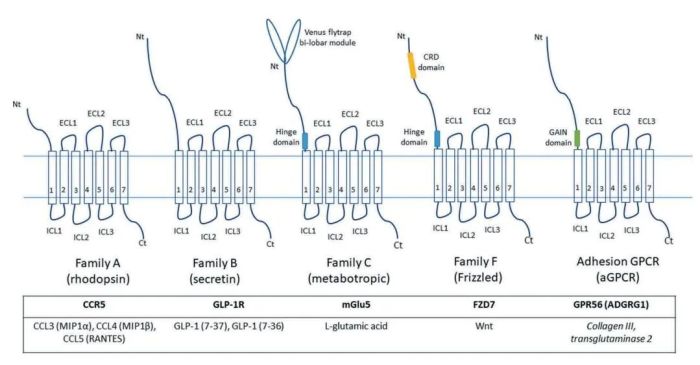
GPCR的主体由7段跨细胞质膜的α螺旋结构构成。
N端和三个loop位于胞外,参与受体与其配体的相互作用;
C端和3个loop位于胞内,其中C端和第3个loop在GPCR蛋白与下游G蛋白的相互作用从而介导胞内的信号传导过程中发挥重要的作用。
特定的配体与GPCR结合,会引起G蛋白的活化,产生第二信使Ca2+或cAMP,将GPCR所接受的胞外信号向下游传递;
但GPCR也可以介导不依赖G蛋白的信号传导,如通过与β-arrestin等分子相互作用调节下游通路。
A类(视紫红质家族)
是迄今为止最大的GPCR家族,包括趋化因子受体和现有最大的药物靶标群。趋化因子受体的主要生物学作用是介导白细胞转移到炎症部位,同时在胚胎发育、病毒感染和免疫细胞增殖、活化和死亡等方面也发挥作用。一些A类GPCRs具有非常短的N-末端结构域;然而,趋化因子和糖蛋白激素受体具有较长的N-末端结构域。
B类GPCRs(分泌素家族)
被肽类激素激活,具有较大的N端结构域。其以代谢作用而闻名,B类GPCRs协调体内代谢平衡调节、神经和内分泌活动。
C类GPCR
有一个更大的双瓣N末端,位于TMD的远端,被称为“Venus flytrap”。这种GPCR家族的另一个显著特征是能够形成具有独特激活模式的二聚体结构。C类GPCRs在中枢神经系统和钙稳态中起重要作用,包括代谢型谷氨酸受体、GABA
B
受体和钙敏感受体
。
粘附GPCRs(aGPCRs)
与B族GPCRs相似,具有较大N端结构域。这个N端结构域与细胞外基质蛋白和其他细胞表面标记物相互作用。aGPCRs的一个独特特征是在TMD附近具有一个独特的高度保守的结构域,即GPCR自动蛋白水解诱导域(GAIN domain),从TMD中自动催化裂解ECD,从而生成一个“栓系”配体,激活aGPCR。aGPCRs复合物N端的其他结构域也参与细胞粘附、细胞间信号传递,被认为在胚胎发育中起重要作用,也有人认为是机械感受器。
GPCRs的最后一个主要类别是
frizzled(FZD)家族,
它还包括smoothened受体(SMO)。FZD家族成员拥有一个约120个氨基酸的胞外结构域,称为fz结构域。fz结构域也被称为CRD(富含半胱氨酸结构域),因为它包含10个高度保守的半胱氨酸残基。FZD-GPCRs被称为Wnt蛋白的富含半胱氨酸的脂糖蛋白激活,并通过Wnt途径传递信号,而SMO则通过Hedgehog途径传递信号。这个GPCR家族参与个体发育和组织内稳态。
最后,尽管已有130个其他GPCRs的序列已识别,但相应的配体仍然未知,这些被称为孤儿GPCRs。考虑到它们在许多疾病适应症中的作用,这是一个重要的有价值的靶点来源,有待于深入的研究。
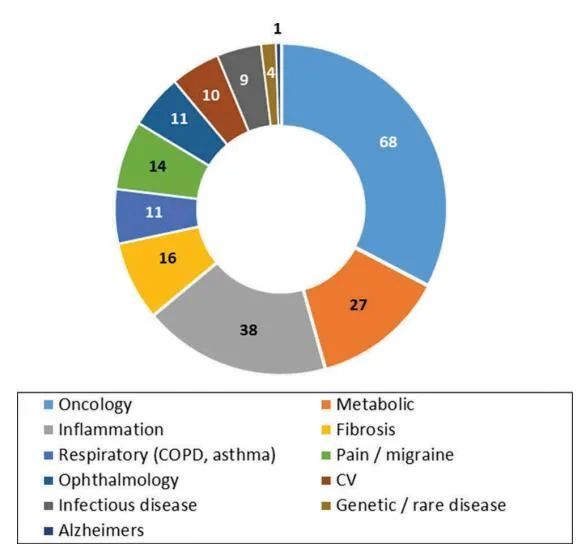
基于公开的可用信息,包括出版物、公司网站、商业数据库,截止到2019年11月,对GPCR抗体靶标的最新分析进行了整理。如下图所示,大多数机会出现在肿瘤、炎症、自身免疫和代谢性疾病领域。但新出现的机会仍在增加,尤其是在传染病、疼痛、偏头痛和纤维化等治疗领域。
事实上,总体来说,目前有超过200个潜在的靶向机会,这些机会具有强大的疾病理论基础,如已知生物学、验证水平(临床或临床前)以及用抗体或类似抗体靶向模型的可行性研究。大约有五分之一的靶标具有显著的有效性(临床2期及以上),一些GPCR指标与一种以上的疾病适应症有关。
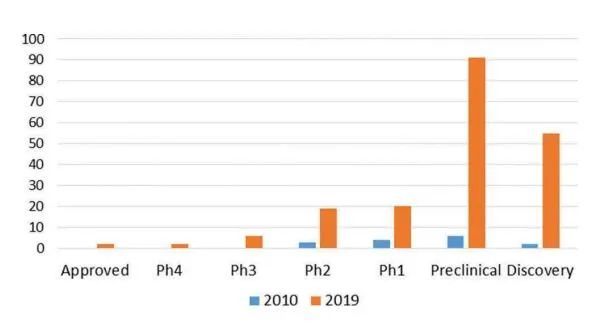
GPCR抗体药物正在开发的模式不仅包括裸抗体,还包括双特异性抗体、ADC、纳米抗体等,甚至包括CAR-T。GPCR抗体也同时作为联合疗法进行研究,例如,与检查点抑制剂抗体或化疗药物,或与细胞疗法相结合。显而易见的是,将单克隆抗体导向GPCR这一重要药物靶点是医药研发者们持续关注的重点,这从全球研发管线中的项目总数和过去十年中更多的GPCR抗体成功进入临床开发得以证明。如下图所示,至少有146个GPCR的单克隆抗体正在早期发现或临床前研究,45个GPCR单克隆抗体正在临床开发中(包括2个批准后研究),其中2个单抗在美国和欧盟获得批准。一些GPCRs涉及多种疾病,因此,这些单抗正在评估一种以上的疾病适应症,处于多重的开发阶段。
GPCR抗体研发管线随着临床开发能力的增强得到快速发展,
目前有超过170个有效的项目针对76个GPCR靶点。
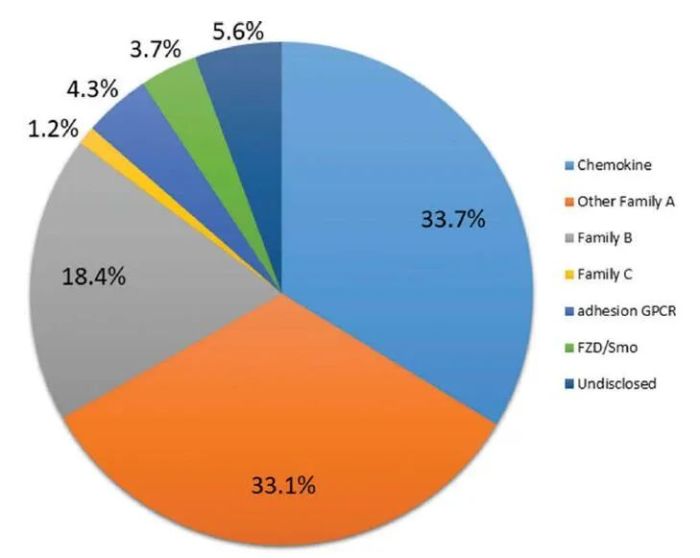
同样引人注目的是,超过三分之二的项目是针对A族GPCR的,其中大约一半的项目又是靶向趋化因子受体的GPCR抗体,这反映了人们对这类GPCR的高度兴趣和成功的把握。趋化因子受体也往往比其他GPCRs具有更高的稳定性。B族GPCRs是下一个最常见的新抗体和工程抗体的开发项目,例如,通过将激动剂肽类似物嫁接到CDR区域或双特异性抗体模式。大多数管线靶向的GPCR要么包含一个大的胞外结构域(ECD),要么N端对天然配体结合(如趋化因子受体)很重要。目前人们对aGPCR和Frizzled家族的兴趣也在增加。靶向C类GPCRs的抗体较少,这可能是由于大多数家族成员与中枢神经系统相关,尽管在某些癌症的外围异常表达使这类受体成为一个有吸引力的靶点。
目前只有两种批准的GPCR靶向单克隆抗体
,
分别是靶向CCR4和CGRP1型受体的mogamulizumab和erenumab
。另一种单克隆抗体正处于临床开发的后期阶段,即针对CCR5的leronlimab(或PRO140),现已达到预注册。目前还有多个GPCR的单克隆抗体处于临床1期或2期的开发阶段。值得注意的是,所有这些靶点都有大的肽配体,下面是简要的案例研究。
Mogamulizumab
是一种人源化的无糖基化IgG1单克隆抗体,通过用人类CCR4的N端氨基酸残基2-29相对应的肽段免疫野生型小鼠获得。其作用机制不是介导CCR4的拮抗作用,而是通过抗体依赖性细胞毒性(ADCC)来实现的,而ADCC已被这种单抗的脱糖状态增强。
Mogamulizumab于2012年在日本首次被批准用于复发或难治性成人T细胞白血病淋巴瘤(ATL),自2018年以来,Mogamulizumab还被批准用于皮肤T细胞淋巴瘤(Sezary综合征,蕈样肉芽肿)的临床治疗。Kyowa Hakko Kirin继续进一步评估该单克隆抗体在其他癌症适应症中的疗效,如其他淋巴瘤和白血病、胃癌以及三阴性乳腺癌(TNBC)。虽然在一些患者中观察到某些罕见的自身免疫副作用(通常影响皮肤),但这些副作用是可以治疗的。一项1期临床试验评估了Mogamulizumab联合nivolumab治疗晚期和转移性癌症的疗效和安全性,因此这可能是癌症治疗的另一种潜在选择。此外,还有10项其他正在进行或计划中的临床试验。
Erenumab
是一种靶向CGRP的全人源IgG2单克隆抗体,通过用可溶性受体蛋白复合物免疫转基因小鼠获得,该复合物包含CGRP受体的N端部分以及辅助蛋白受体活性修饰蛋白1(RAMP1)。这种单克隆抗体是一种与CGRP配体直接竞争的拮抗剂,CGRP配体是一种小的神经肽,在慢性疼痛和偏头痛的情况下具有强大的血管扩张作用。CGRP配体在受体上具有广泛的结合表位;因此,抗体更适合于破坏这种相互作用,并且在与CGRP竞争时,erenumab在特异性和效力方面比小分子药物具有优势,小分子药物由于非靶向结合而导致肝毒性。2018年,在美国和欧盟,Erenumab首次被批准用于偏头痛的临床治疗。安进和诺华在这一项目上进行了合作;然而,在双方之间正在进行诉讼的情况下,这种合作的未来仍有待确定。同时,该单克隆抗体的临床开发仍在继续,包括第4阶段上市后研究(NCT03977649,NCT03971071),用于治疗发作性和慢性偏头痛,以及日本正在进行的预防偏头痛的第3阶段临床研究。总共有19个正在进行的或计划中的临床试验,到目前为止,临床研究和非临床安全性评估没有观察到任何重大的安全问题。
Leronlimab
(以前被称为PRO140)是一种靶向CCR5的人源化IgG4单克隆抗体,CytoDyn已经开发进入针对多个疾病的不同临床阶段,即CCR5嗜性H
IV感染、转移性TNBC、转移性结直肠癌、非酒精性脂肪性肝炎(NASH)和移植物抗宿主病(GvHD)。
2012年,CytoDyn从Progenics Pharmaceuticals收购了leronlimab。其作用机制通过掩蔽CCR5抑制病毒进入,但不干扰正常的CCR5信号从而保护健康的T细胞;此外,CCR5已被证明在癌症和免疫介导的条件下发挥重要作用。leronlimab证明的另一种作用机制是阻断CCR5阳性癌细胞钙通道信号的能力,这是肿瘤侵袭和转移过程中固有的。目前,该单克隆抗体正处于预注册阶段,预计在2020年上半年批准leronlimab和HAART用于HIV感染,此前已获得FDA的快速通道认证。2019年3月,CytoDyn使用FDA的滚动审查流程提交了BLA申请的第一部分。一旦成功获得FDA的批准,这种单克隆抗体将代表第三个GPCR靶向抗体上市。2019年12月,CytoDyn与Vyera Pharmaceuticals签订了商业化和许可协议(CLA)和供应协议。计划联合使用leronlimab治疗CCR5嗜性HIV感染(NCT02859961)。这种单克隆抗体的另一个吸引人的特性是,除了标准的静脉注射外,它还可以作为皮下注射进行自我管理。
一项正在进行的单药剂量递增2b期/3期临床试验(NCT02859961)的最新数据表明,接受leronlimab的患者在大约一年甚至更长的时间内保持病毒载量抑制。Leronlimab已经在800多人中成功地完成了9项临床试验,包括关键的第3阶段试验(Leronlimab与标准抗逆转录病毒疗法相结合,在有治疗经历的艾滋病毒感染患者中,81%完成试验的患者实现了HIV病毒载量抑制低于50cp/mL,从而达到了主要终点)。
除了HIV外,CytoDyn正在对转移性结直肠癌和NASH患者的2期临床试验中评估leronlimab的安全性和有效性。与卡铂联合治疗转移性TNBC(NCT03838367)已被授予快速通道认证,并且已经观察到强烈的临床反应;还有用于预防GvHD(多个2期临床研究,例如NCT02737306)的孤儿药物指定认证,结果有望在2020年上半年实现。因此,该单抗在多个治疗领域具有积极的治疗作用,包括最近宣布将IND申请第二阶段临床试验的治疗方案因感染COVID-19冠状病毒而导致呼吸系统并发症的患者。
在过去的十年里,一些GPCR抗体已经进入到了临床2期的开发阶段,总结如下:
volagidemab
(REMD-477;以前称为AMG-477)由科信美德开发靶向胰高血糖素受体(GCGR),正在作为青少年1型糖尿病(T1D)和2型糖尿病(T2D)开发。
glutazumab
(也被称为GMA102或GMA105)由鸿运华宁开发靶向GLP-1受体的人源化抗体与GLP-1片段融合而成,正在针对T2D和肥胖进行开发,这个抗体提出了另一种靶向策略,即结合抗体通过融合肽基配体而赋予的功能,这样的结构表现出优于同类GLP1类似物的安全性和耐受性。
AMG-301
靶向PACAP受体,也称为PAC1,最近完成了预防偏头痛的第2阶段研究;
nimacimab
靶向CB1,正在开发治疗糖尿病性胃轻瘫。
plozalizumab
(也被称为MLN1202)是靶向CCR2的单克隆抗体,进入了多种疾病适应症的第二阶段研究,但现在已经停止。
ulocuplumab
靶向的是CXCR4,为了评估各种淋巴瘤和白血病的疗效,进行了几项临床研究,并进入了多发性骨髓瘤3期早期患者单名访问计划,但所有研究都被停止,可能是由于与标准护理相比缺乏疗效。该抗体目前正处于Waldenstrom巨球蛋白血症的临床2期开发阶段。
IPH-5401
以C5aR为靶点,最初用于类风湿关节炎的临床开发;然而,2017年7月,Innate Pharma从诺和诺德获得了该单克隆抗体的许可。IPH-5401目前正在免疫肿瘤学的背景下进行一项1期/2期联合研究(NCT03665129)和检查点抑制剂durvalumab(抗PD-L1)治疗选定实体瘤(NSCLC、HCC、RCC、尿路上皮细胞癌)的患者。这种单克隆抗体的拮抗作用可阻断TME中的MDSCs,从而增强CD8 T细胞的浸润和功能。
另外一些GPCR抗体已进入或正在进入临床1期的开发阶段,包括针对CX3CR1(纳米抗体)、FZD10(放射性结合物)、LGR5、CXCR4(抗体偶联药物)、TSHR、LGR5和EGFR双特异性、ETa和一个SSTR2和CD3 单链抗体-Fc的双特异性抗体。
getagozumab
是由鸿运华宁开发靶向内皮素受体(ETa)的单克隆抗体药物,临床适应症为肺动脉高压。2017年获得美国FDA孤儿药资格认定。在澳大利亚开展的Ⅰa期临床实验中,表现出优于现有ETa阻断性小分子药物的极其优越的安全性。目前,该药物已同时获得中美的临床实验许可,开展国际多中心的针对肺动脉高压患者的Ib期临床试验。
DS-6157a
是一种靶向GPR20的ADC药物,包括靶向GPR20的抗体、蛋白酶可裂解的GGFG接头,DXd拓扑异构酶1抑制剂,该药物计划于2020年3月开始用于治疗晚期胃肠道间质瘤的第一阶段临床评估。此外,还有另一种靶向CCR7的ADC药物治疗CLL(也在第1阶段)是这方面的最新临床进展。
处于临床前开发阶段的还有其他几种双特异性抗体和adc,这些是否能够有效地转化为临床仍有待观察。
GPCRs是重要的治疗靶点,其作为抗体靶点的机会正日益被承认,这一点在过去十年中所取得的进展证明了这一点。目前,针对GPCR的治疗性抗体的研发管线和临床试验正在不断扩大。近年来,随着我们对GPCR生物学方面的不断深入研究,特别是肿瘤免疫的理解上取得了越来越大的成功,为GPCR的治疗性抗体无论是作为单一疗法还是联合疗法的应用提供了广阔的前景。许多技术障碍仍然存在,但并不是无法克服的,因为受体的蛋白质工程、体外展示库和转基因动物(抗体库的人源化)以及过表达受体和蛋白质制剂的方法的研究也在不断的发展和突破。这些进展,再加上强大的高通量筛选系统,对GPCR结构的深入了解,靶点验证,以及证实临床相关性的转化生物学研究,为克服GPCR抗体药物发现和开发的瓶颈提供了可能,预计GPCR抗体药物的发展在下一个十年同样会令人鼓舞,带给我们不断的惊喜。
1. A review of antibody-based therapeutics targeting G protein-coupled receptors: an update. Catherine J Hutchings. Expert Opin Biol Ther. 2020 Aug;20(8):925-935.
2. 各公司官网









加载更多