【干货】qPCR常见问题及解决方案这一篇就够了
在RT-qPCR的实验过程中,大家或多或少都会遇到扩增曲线异常、熔解曲线异常、重复性差等问题。给大家整理了SYBR Green染料法的常见问题及解决方案,以供大家参考。
Part 1 扩增曲线异常
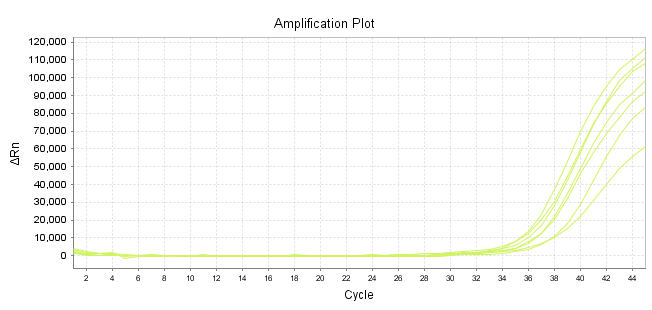
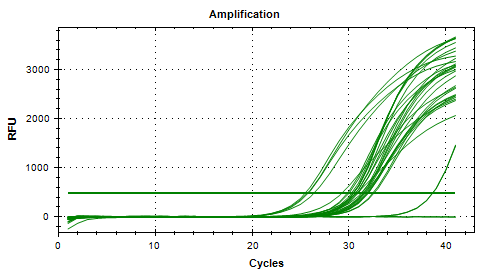
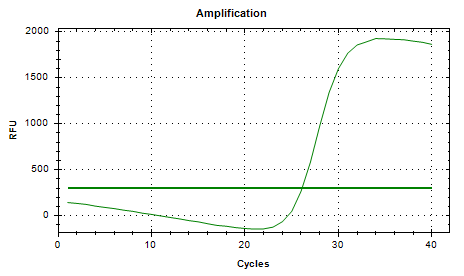
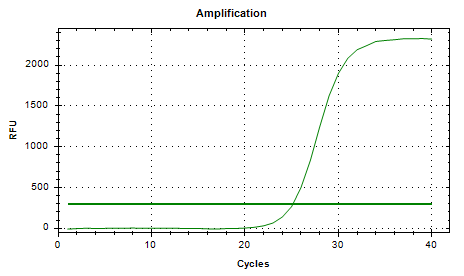
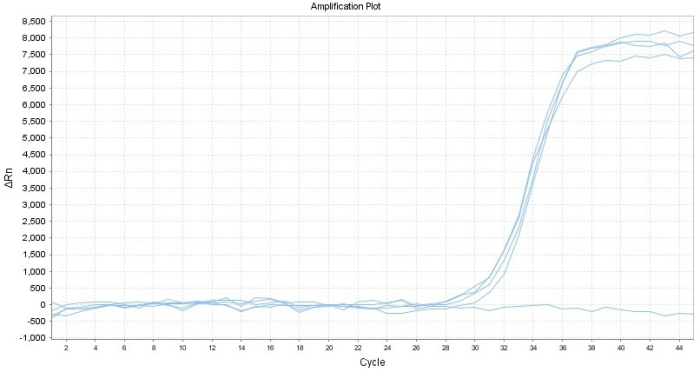
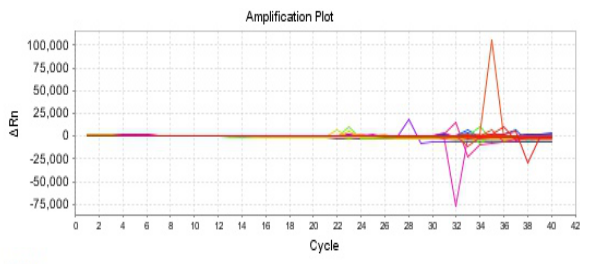
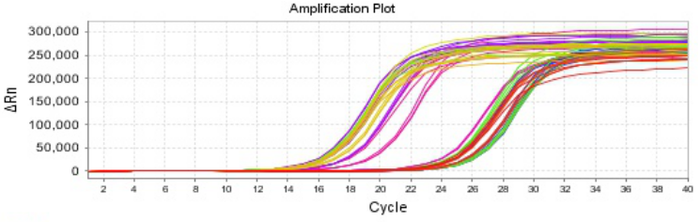
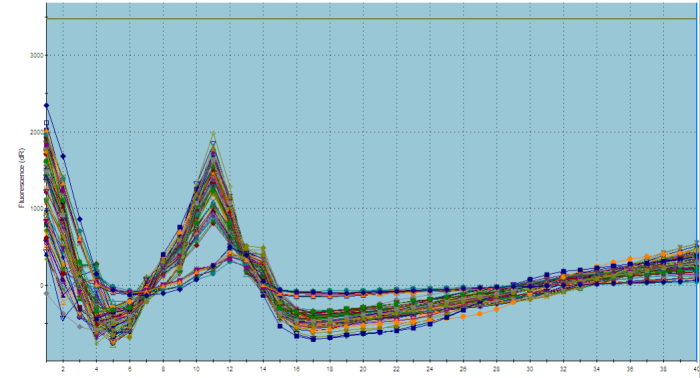
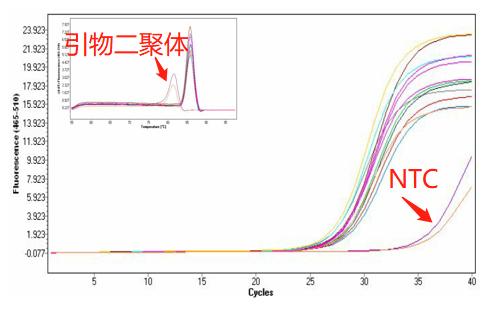
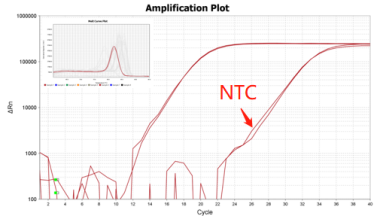
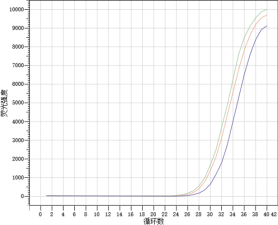
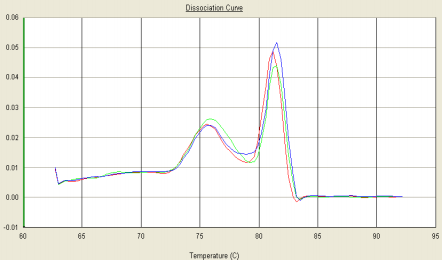
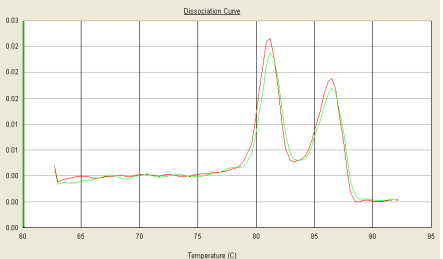
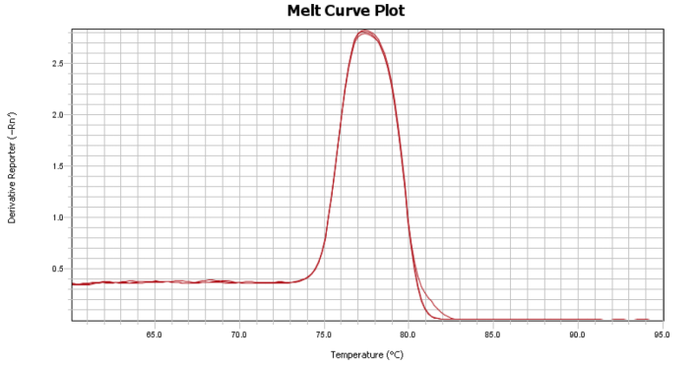
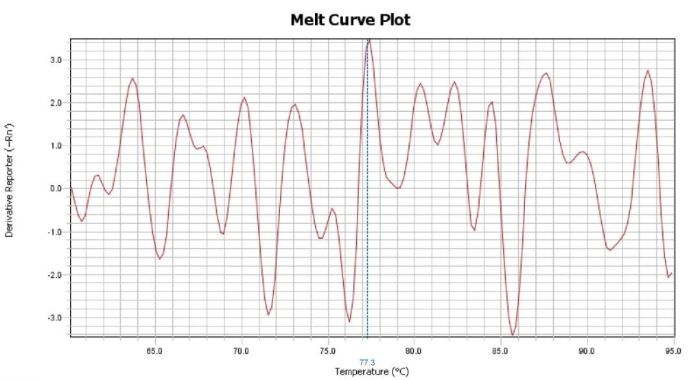
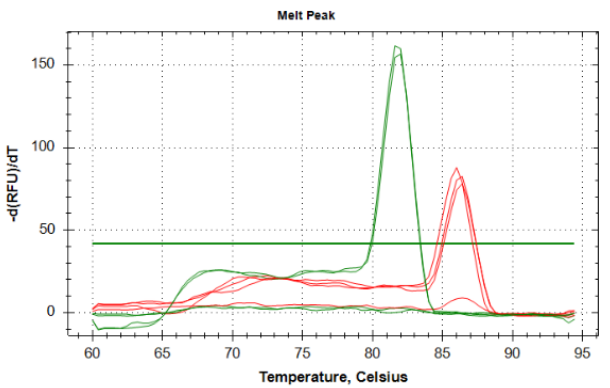
Part2 熔解曲线异常
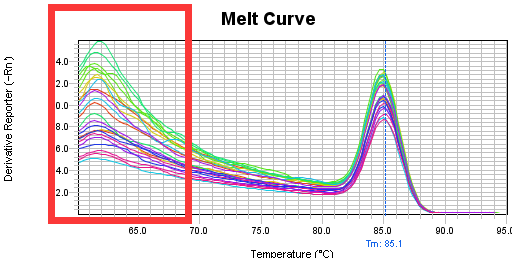
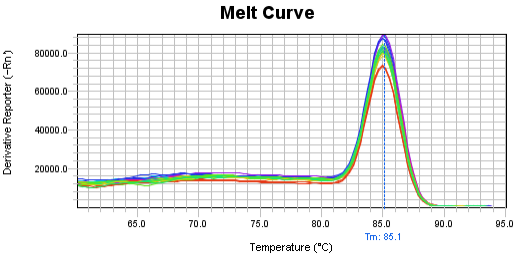
展源
何发
相关文章
-

qPCR的常见问题
2023-11-08
-

新手须知的qPCR操作技巧
2023-04-17
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

如何抓住qPCR数据分析的关键?
2023-04-21
-

qPCR数据可用性判断及数据处理方法
2024-04-24
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

qPCR常见问题及解决方案,快收藏~
2024-01-05
-

【新手须知】qPCR操作技巧详解!
2024-05-24
-

qPCR实验中引物设计的详细步骤介绍
2023-01-18
-

【收藏】qPCR常见问题及解决方案,搞定!
2023-01-06

加载更多