你了解原子结构吗?终于搞懂了!
不同材料有着不同的性能,同一材料经过不同的加工工艺后也会有不同的性能,这些都归结于内部结构的不同,我们今天就着重讲一下原子结构(Atomic Structur)的相关知识。
原子模型为由原子核(质子和中子)和电子构成,电子绕核做不规则运动,形成的电子云模型。原子核内有中子和质子,体积很小,却承担了原子绝大部分的质量。电子绕原子核在一定轨道上旋转,随着主量子数n值的增加,电子层按K、L、M、N、O…的顺序排列,电子的能量逐渐升高、电子离原子核的平均距离也越来越大。电子层可容纳最多电子的数量为2n²。图示有原子核,K、L、M、N壳层。
原子的原子序数表示原子核中的质子数(带正电的粒子),在中性原子中,原子序数也等于电荷云中的电子数。
元素的相对原子质量是该元素的6.023×10
23个原子(阿伏伽德罗数N
A)的质量,单位为克。元素周期表中最下面的数字为相对原子质量。
量子数是原子中分配电子到离散能级的数。每个电子所属的能级由四个量子数决定。
原子尺寸由原子半径决定,影响原子半径的因素有三个:一是核电荷数,核电荷数越多原子核对核外电子的引力越大(使电子向原核收缩),则原子半径越小;当电子层数相同时,其原子半径随核电荷数的增加而减小;二是最外层电子数,最外层电子数越多半径越大;三是电子层数(电子的分层排布与离核远近空间大小以及电子云之间的相互排斥有关),电子层越多原子半径越大。当电子层结构相同时,质子数越大,半径越小。
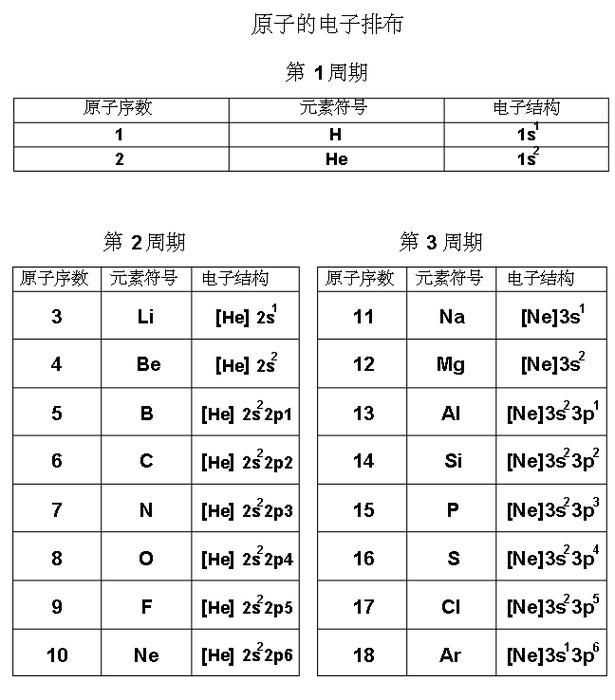
电子结构(Electron configurations)
泡利不相容原理规定,一个原子中不可能存在有四个量子数完全相同的两个电子。下图以H原子为例,分析了电子排布,蓝点只有一个填充电子。
电负性是元素的原子在化合物中吸引电子的能力的标度。元素的电负性越大,表示其原子在化合物中吸引电子的能力越强。元素电负性数值越大,表示其原子在化合物中吸引电子的能力越强;反之,电负性数值越小,相应原子在化合物中吸引电子的能力越弱(稀有气体原子除外)。
●随着原子序号的递增,元素的电负性呈现周期性变化。
●同一周期,从左到右元素电负性递增,同一主族,自上而下元素电负性递减。对副族而言,同族元素的电负性也大体呈现这种变化趋势。因此,电负性大的元素集中在元素周期表的右上角,电负性小的元素集中在左下角。
●电负性越大的非金属元素越活跃,电负性越小的金属元素越活泼。氟的电负性最大(4.0),是最容易参与反应的非金属;电负性最小的元素(0.79)铯是最活泼的金属。
以上就是原子结构的知识,希望大家好好理解,为学习材料学打下一个好的基础。如果还有不理解的地方,那就直接查看原子的电子排布大全吧。











加载更多