【收藏】制剂开发中,分析人员应注意的几件事
1.研究API的降解途径
拿到一个新项目,在未开始具体试验前,应检索参比制剂相关信息,API中英文献、FDA评估报告、日本IF文件、国内外药典质量标准,并对文献中API的降解杂质、降解途径和机理进行汇总,包括固体状态、溶液状态等多种情况。如果为衔接前人的项目,还应对已有数据进行系统分析和总结。
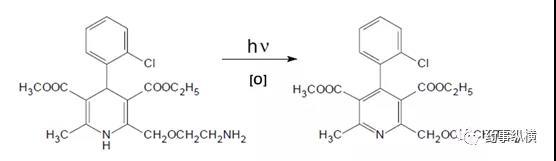
例如根据文献报道,氨氯地平在光照、氧化条件下会产生相同的降解杂质(见图1)。
在对不同溶出曲线进行考察时,会遇到不同pH值的溶液,供试品在不同pH值溶液中的稳定性如何?这些需要进行考察,采用API进行考察即可。有时API在对照品溶液中的稳定性也需要研究(见图2)。
如果制剂工艺中采用了湿法制粒、高温干燥、微分化等工艺,那么API在这些条件下有无降解,其中某种水解杂质是否有增加,晶型在溶解或干燥的过程中有无晶型的转化,这些都是要分析人员要了解的。当工艺中可能会接触湿、热、光照等与条件时,应对中间产品或中间体的贮藏时间、贮藏条件进行考察,掌握其降解程度、条件的敏感性,采用好必要的保护措施。
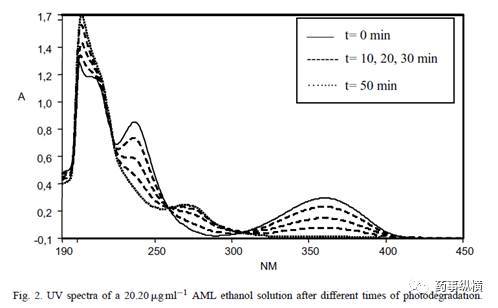
图2. 氨氯地平的乙醇溶液光稳定性考察
在对降解杂质、降解途径进行研究时所采用的方法应具有较好的专属性,在制剂处方开发早期,可在杂质谱分析的基础上选择药典或文献中比较成熟的方法。
进行降解途径研究中,应重点关注或确认在某种条件下的降解情况与国内文献是否一致,如氧化、酸碱水解、光照、高温、高温+高湿等条件。如根据原辅料相容性基本原理分析,有可能存在相互作用,那么应该选择出恰当的检测方法,如氨氯地平USP方法就可以检测乳糖、葡萄糖、半乳糖和氨氯地平的加合物(见表1),这些杂质与所采用的处方有关,如果有的标准中没有规定这些杂质,说明可能没有采用乳糖等辅料,因此制剂的杂质分析与API是有一定差异的,需要结合处方工艺甚至加速长期试验结果一起去分析(见图3)。
表1. USP氨氯地平片有关物质限度表
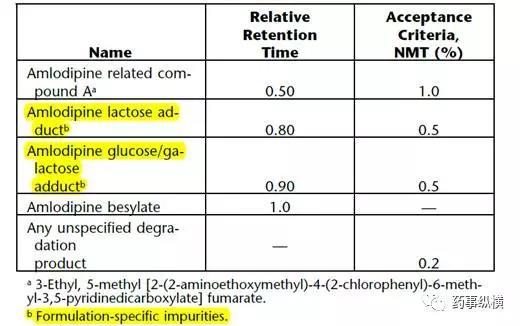
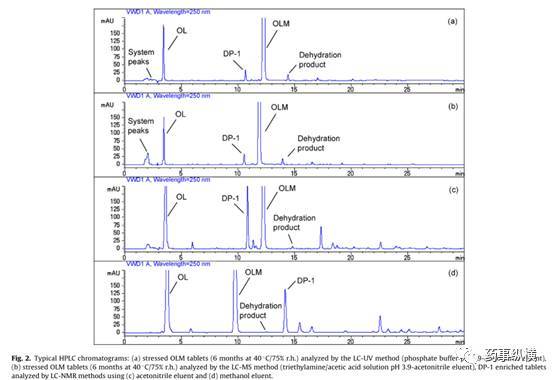
图3. 奥美沙坦酯片加速6月降解杂质DP-1研究图谱
在API的降解途径研究阶段,对文献检索是否全面?理解与把握是否到位?非常重要,不仅要求分析人员要具有较高的检索能力,更需要具有较高的英文阅读能力、逻辑分析能力。不要仅仅从“检测样品”的角度去考虑问题,需要站在整个项目的宏观角度,“质量研究”的角度去考虑问题,需要主动配合制剂进行分析研究。
2.研究API的溶解性和溶液稳定性
制剂样品中API的溶解性和溶液稳定性影响着最终质量标准的建立、过程中制剂样品结果的准确性。那些对于原料药检测中用到的溶解溶剂,对于制剂而言则不一定适用,如某API有关物质溶剂为纯乙腈,但是制剂中由于辅料的影响使用纯乙腈往往会导致API的溶解度降低,这时可能需要考虑在有机相中加入少量水相来增加制剂中主药的溶出和溶解,但是溶液稳定性仍要进行考察。
当API为手性药物需要检测异构体时,如果必须采用正相系统,那么API在异丙醇、无水乙醇、正己烷等中的溶解度也是需要重点考察的,这有助于在方法开发过程中评估所采用的溶剂、样品处理方式。
通常同一份溶剂,单独API的溶解度会比API+辅料的溶解度大,但这也与API的结构式、处方中辅料的种类和量有关,有些辅料能够改变最终溶液的pH,影响API的溶解度。分析人员应该了解API的结构式以及pKa、溶解度、pH依赖性等特点,也要了解处方中所用的辅料的名称、性质、用量情况,不要在做制剂分析时连处方组成还不清楚。
分析人员有时在样品配制过程中可以测定一下溶液的pH,这可能有助于方法的开发与建立。如某药物在酸性条件下(如pH值1-2)条件下稳定,而制剂溶液由于辅料的原因溶液发生了pH改变,那么其稳定性就可能会受到影响,导致结果不准确,所以应该对溶剂进行优化筛选考察。
样品溶液(如含量、含量均匀度、溶出、有关物质等)的稳定性在检测中很重要,分析人员需要评估溶液是否稳定,可以采用归一化法,考察在室温、冷藏、避光等条件下的稳定性情况,如果不稳定,应了解降解速度如何?有哪些降解产物出现?主峰面积变化%(通常认为含量、溶出等主峰面积RSD小于2.0%可以接受)?哪些条件可以减少或避免降解?选择低温保存样品、在短时间内测定、使用UPLC、还是短色谱柱可以解决稳定性问题吗?
3.多掌握一些原辅料相容性知识
辅料本身是一种具有某种官能团的化学物质,这些官能团在制剂的正常贮藏条件下或加速条件下可能与API发生相互作用,因此辅料不能认为是惰性的。辅料中常见的影响因素有水分、pH值等,当主药对湿度敏感时,水分限度就是一个关键的因素,因此有时需要控制辅料中水分的含量。许多药物的水解反应或氧化反应均受pH值的影响,因此当发现这种影响存在时,不同厂家来源的辅料或不同型号的辅料就需要考察和制定内控标准。常见辅料官能团及其功能见表2。
表2. 常见的辅料基团及其功能
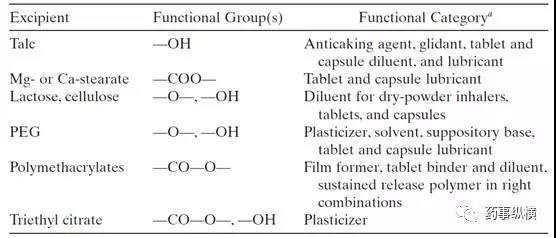
如果辅料与主药相互作用,产生的杂质分子量可能比主药大,也可能比主药小,这意味着在HPLC中可能比主药先出来,也可能后出来,离子型的杂质可能就先洗脱出来(比如氨氯地平的加合物杂质),对于中性的杂质可能后洗脱出来。
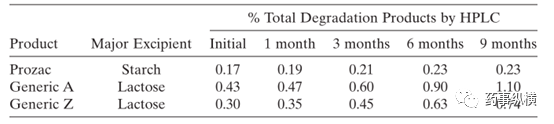
乳糖和盐酸氟西汀会发生作用,这是一个典型的美拉德反应。参比制剂与两个仿制药在加速条件(40°C/75% RH)对比研究表明,降解杂质不一致,研究表明这与辅料的类型和处方中的用量有关(见表3)。
表3. 盐酸氟西汀制剂在加速条件(40°C/75% RH)的稳定性对比
原辅料相容性试验对制剂有关物质等检测方法选择和优化,以及质量标准的建立具有重要提示或指导意义。
4.多了解一些HPLC法在制剂分析中的应用
HPLC法是制剂分析中最常用的方法,因此应该多了解HPLC法的特点,如反相色谱、正相色谱、离子对色谱法;熟悉并慢慢积累各种检测器的类型和应用特点,如ELSD、RID、UV、PDA、FLD、CAD等,可以用于没有UV吸收、有UV吸收、弱UV吸收等物质的检测。不同的试验目的关注重点是不一样的。
通常HPLC法有如下应用:
(1)批检验和稳定性考察:鉴别、溶出度、有关物质、异构体、含量均匀度、含量测定
(2)工艺验证:混合均匀度、溶出曲线
(3)清洁验证:需要灵敏度较高、专属性好的HPLC法
在有关物质研究中,制剂生产或稳定性中产生的杂质应进行研究和控制,HPLC方法应能够对所有已知杂质和未知杂质进行分离,具有一定的专属性(空白辅料不干扰、与有关物质分离、峰纯度符合要求)、重复性(精密度)、定量(线性、范围、LOD、LOQ、回收率),耐用性较好。有时原料药所使用的有关物质方法适用于制剂,有时不适用。当工艺杂质、降解杂质较多时可以考虑在原料药的方法基础上进行优化,重点考察辅料干扰情况、溶剂选择情况。
5.认识降解试验的作用
通常,降解试验具有如下作用:
(1)方法开发与验证阶段考察方法的专属性
(2)快速确定API和制剂的降解途径,降解杂质
(3)识别哪些是API的降解杂质,哪些是API与辅料相互影响才产生的降解杂质
(4)考察API的稳定性和对某种条件的敏感性
(5)考察API和制剂在液体或固体状态下的稳定性
(6)研究在高于加速条件下API或制剂的稳定性,指导包材的选择和贮藏条件
(7)研究API或制剂在热、酸碱水解、氧化、光照、高温高湿等条件下的降解机理
在做降解试验时,每种药物的降解条件都是不一样的,指导原则自然不会规定具体的降解条件。在处方工艺开发过程中,分析人员应该研究降解条件,最好应多次进行重复,考察其重现性(特别是当采用降解溶液作为系统适用性溶液的时候),可以采用制剂也可以采用API+辅料的形式。降解程度一般为主药降解5%-10%,但有时如果发生明显的次级降解也可适当降低程度。
一般降解条件为:
(1)热:室温、40℃、50℃、60℃
(2)光:ICH指导原则
(3)湿:75%RH
(4)酸:0.1mol/L盐酸
(5)碱:0.1mol/L氢氧化钠
(6)氧化:3%H2O2、AIBN、BPO等
(7)湿热:50℃+75%RH
需要注意的是,分析人员应清楚每一项降解的机理和程度,与分成人员进行好沟通,不宜降解过度,导致降解试验失真。有些降解试验结果不一定能够真实反映出来,需要体现出一定的相关性和预测性。
6.关注样品溶液的制备方法
有些制剂分析中,采用已有标准中的供试品溶液制备方法,不一定能够对主药进行完全提取。如果理论分析某总混样品中主药含量应为100%,实际只有97%,那么应该结合工艺损失、取样代表性、分析方法样品溶液制备过程等方面进行综合分析。
例如,在Starlix ®和盐酸二甲双胍复方制剂中,在回收率试验中,发现二甲双胍的回收率很低,起初认为是溶剂提取不完全,因此采用了不同溶剂进行考察,结果仍没有改善(见表4)。难道是二甲双胍与某个辅料在溶液中发生了相互作用?这时应该怎么研究呢?分析人员采用二甲双胍与所有辅料进行干混合,然后逐一去掉一个辅料,配制成溶液,结果表明当去掉交联羧甲基纤维素后,二甲双胍的回收率合格了,达99.7%(见图4),这说明二甲双胍与交联羧甲基纤维素可能在溶液中发生了反应,机理见图5。
表4. 不同溶剂下二甲双胍的提取回收率

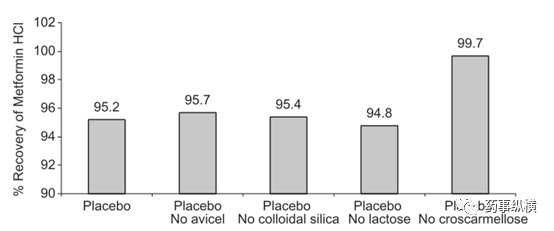
图4. 不同辅料组成下二甲双胍的提取回收率
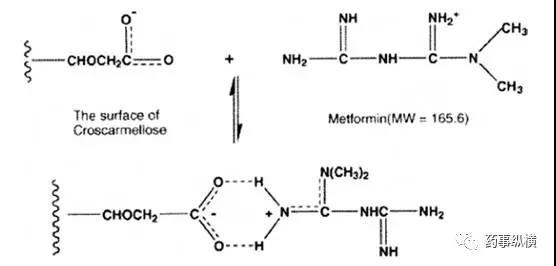
图5. 二甲双胍与交联羧甲基纤维素官能团的相互作用
这个例子说明,辅料在固体时与API没有相互作用,但是在溶液中却发生了作用。所以在制剂配制成溶液或设计处方时应考虑多种因素,如所选溶剂的组成,是纯有机相还是纯水相,或二者的比例如何;正相分析时一般为非极性和极性溶剂的混合物。提取回收率与溶剂(种类、量)、提取条件(时间)、辅料组成、溶液中的主药和辅料的理化性质有关。
一个好的分析人员遇到问题时应该能够对这些问题进行解释,过程中要不断与合成人员、制剂人员沟通。
7.在具体工作中提升能力
在药物研发整个链条中,与分析打交道较多的是合成、制剂,随着我国研发思路和理念的变化,已经早已不存在哪个更重要的问题了,药品从立项到上市整个过程中任何一环都同样重要,没有主次。
在制剂分析中,研发分析人员与QC人员有很大的区别,需要研发分析人员在设计方法、方案时多考虑科学性、合规性、逻辑性;同时还要兼顾各种效率,比如溶出曲线检测时大量样品如何高效检测?准确检测?采用UV法?UPLC法?HPLC短柱?稀释后进样?直接进样?这些都要进行全面考量。从事制剂分析,也要懂制剂,懂某个品种处方工艺设计的思路和关键点、控制点。在具体实践中多思考、多总结,不要局限于分析本身,在实践中进步才是分析人员提升自己的方向。
研发分析人员要熟悉法规,不仅仅是质量研究方面的,在合成、制剂、注册、医学、专利、GMP、QC、QA等各个方面都要熟悉才行。分析是一个全面的工作,需要在过程中互相理解、包容、沟通,沟通可以解决一切问题!分析不仅仅是一份工作,更是一份责任,因为企业里所有环节的人都面对同一个客户——CFDA!
制剂分析人员在实际工作中会积累起大量的数据,这些数据如何发挥更大的作用?作者想用两个字进行概括—— “控制”,延伸讲就是源头控制、过程控制、重点控制、全面控制。要注意数据间的关系,数据体现出来的逻辑关系、制剂处方工艺中暴露出的问题,是物料、中间体的属性问题,还是工艺问题?如何保证批间的均稳健性,重现性?往往需要坚持“控制”的理念。
分析人员不仅仅是检测样品、质量研究、稳定性考察、建立标准、开发方法、方法学验证,更重要的是方法、数据、问题等背后的为什么,要知其然,知其所以然。
总之,制剂开发中,分析人员应注意的事情远远不止上述内容,分析人员要多总结、多思考、多沟通、多包容,为项目做到负责!
(文章来源:药品研发驿站 由小析姐整理编辑)
展源
何发
相关文章
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-
红外光谱分析,你了解多少?
2021-01-11
-

三聚氰胺,你还要害多少人
2020-05-27
-

HPLC检测器,你了解吗?
2024-03-06
-

超净工作台原理,使用与维护
2020-05-27
-

选对色谱柱,快速开发方法
2020-05-27
-
检测有机氯类农药,气相色谱法检测法
2021-01-12
-

'die','device','chip'有什么区别?
2024-02-21
-

色谱峰裂分,前拖尾的诊断
2020-05-27

加载更多