生物质谱技术在蛋白质组学中的应用
一、 前言[1,2]
基因工程已令人难以置信的扩展了我们关于有机体DNA序列的认识。但是仍有许多新识别的基因的功能还不知道,也不知道基因产物是如何相互作用从而产生活的有机体的。功能基因组试图通过大规模实验方法来回答这些问题。但由于仅从DNA序列尚不能回答某基因的表达时间、表达量、蛋白质翻译后加工和修饰的情况、以及它们的亚细胞分布等等,因此在整体水平上研究蛋白质表达及其功能变得日益显得重要。这些在基因组中不能解决的问题可望在蛋白质组研究中找到答案。蛋白质组研究的数据与基因组数据的整合,将会在后基因组研究中发挥重要作用。
目前蛋白质组研究采用的主要技术是双向凝胶电泳和质谱方法。双向凝胶电泳的基本原理是蛋白质首先根据其等电点,第一向在pH梯度胶内等电聚焦,然后转90度按他们的分子量大小进行第二向的SDS-PAGE分离。质谱在90年代得到了长足的发展,生物质谱当上了主角,蛋白质组学又为生物质谱提供了一个大舞台。他们中首选的是MALDI-TOF,其分析容量大,单电荷为主的测定分子量高达30万,干扰因素少,适合蛋白质组的大规模分析。其次ESI为主的LC-MS联机适于精细的研究。本文将简介几种常用的生物质谱技术,并着重介绍生物质谱技术在蛋白质组学各领域的应用。
二、 生物质谱技术[3,4]
1.电喷雾质谱技术(ESI)[5]
电喷雾质谱技术( Electrospray Ionization Mass Spectrometry , ESI - MS)
是在毛细管的出口处施加一高电压,所产生的高电场使从毛细管流出的液体雾化成细小的带电液滴,随着溶剂蒸发,液滴表面的电荷强度逐渐增大,最后液滴崩解为大量带一个或多个电荷的离子,致使分析物以单电荷或多电荷离子的形式进入气相。电喷雾离子化的特点是产生高电荷离子而不是碎片离子,
使质量电荷比(m/ z) 降低到多数质量分析仪器都可以检测的范围,因而大大扩展了分子量的分析范围,离子的真实分子质量也可以根据质荷比及电荷数算出。
2.基质辅助激光解吸附质谱技术(MOLDI)[5-7]
基质辅助激光解析电离(MOLDI)是由德国科学家Karas和Hillenkamp发现的。将微量蛋白质与过量的小分子基体的混合液体点到样品靶上,经加热或风吹烘干形成共结晶,放入离子源内。当激光照射到靶点上时,基体吸收了激光的能力跃迁到激发态,导致蛋白质电离和汽化,电离的结果通常是基体的质子转移到蛋白质上。然后由高电压将电离的蛋白质从离子源转送到质量分析器内,再经离子检测器和数据处理得到质谱图。TOF质量分析器被认为是与MALDI的最佳搭配,因为二者都是脉冲工作方式,在质量分析过程中离子损失很少,可以获得很高的灵敏度。TOF质量分析器结果简单,容易换算,蛋白质离子在飞行管内的飞行速度仅与他的(m/z)-1/2成正比,因此容易通过计算蛋白质离子在飞行管内的飞行时间推算出蛋白质离子的m/z值。与传统质量分析器相比,更易得到高分辨率和高测量精度;速度快,离子飞行时间仅为几个μs和约100μs之间;质量范围宽,可以直接检测到几十万道尔顿的单电荷离子。飞行时间质量分析器被认为是21世纪最有应用前景的质量分析器。
3.傅立叶变换-离子回旋共振质谱(FT-ICR MS)[8,9]
傅立叶变换-离子回旋共振质谱法(FT-ICR
MS)是离子回旋共振波谱法与现代计算机技术相结合的产物。傅立叶变换-离子回旋共振质谱法是基于离子在均匀磁场中的回旋运动,
离子的回旋频率、半径、速度和能量是离子质量和离子电荷及磁场强度的函数, 当对离子施加与其回旋频率相同的射频场作用时, 离子将同相位加速到一较大的半径回旋,
从而产生可被接受的类似电流的信号。傅立叶变换-离子回旋共振质谱法所采用的射频范围覆盖了欲测定的质量范围,所有离子同时被激发, 所检测的信号经过傅立叶变换,
转换为质谱图。其主要优点有:容易获得高分辨;便于实现串极质谱分析;便于使用外电离源并与色谱仪器联用。此外,他还有灵敏度高,质量范围宽,速度快,性能可靠等优点。
4.快原子轰击质谱技术(FABMS)
快原子轰击质谱技术( Fast Atom Bomebardment Mass Spectrometry , FABMS)
是一种软电离技术,是用快速惰性原子射击存在于底物中的样品,使样品离子溅出进入分析器,这种软电离技术适于极性强、热不稳定的化合物的分析,特别适用于多肽和蛋白质等的分析研究。FABMS能提供有关离子的精确质量,从而可以确定样品的元素组成和分子式。而FABMS
-MS 串联技术的应用可以提供样品较为详细的分子结构信息,从而使其在生物医学分析中迅速发展起来。
三、蛋白质的分析鉴定[3, 4, 10]
随着质谱技术的发展,分子量的测定已从传统的有机小分子扩展到了生物大分子。MALDI-MS技术以其极高的灵敏度、精确度在蛋白质分析中得到了广泛的应用。该技术不仅可测定各种疏水性、亲水性和糖蛋白的分子量,还可直接测定蛋白质混合物的分子量。这可认为是蛋白质分析领域的一项重大突破。
蛋白质组的研究是从整体水平上研究细胞或有机体内蛋白质的组成及其活动规律。质谱技术作为蛋白质组研究的三大支撑技术之一,除了用于多肽,蛋白质的分子量测定外,还广泛的应用于肽指纹图谱测定及氨基酸序列测定。
肽指纹图谱(Peptide Mass Fingerprinting,
PMF)测定是对蛋白酶解或降解后所得多肽混合物进行质谱分析的方法。质谱分析所得肽断与多肽蛋白数据库中蛋白质的理论肽断进行比较,判断出所测蛋白是已知还是未知。由于不同的蛋白质具有不同的氨基酸序列,不同蛋白质所得肽断具有指纹特征。采用肽指纹谱的方法已对酵母、大肠杆菌、人心肌等多种蛋白质组进行了研究。
对肽序列的测定往往要应用串连质谱技术,采用不同的技术选择特定质核比的离子,并对其进行碰撞诱导解离,通过分析肽段的断裂情况推导出肽序列。
四、后转录修饰的蛋白质的检测和识别
在蛋白质组的研究中,蛋白质和多肽的序列分析已不局限于阐明蛋白质的一级结构,对翻译后的修饰的进一步分析也是蛋白质化学的一项重要任务。这种修饰对于蛋白质的功能非常重要,如:细胞识别中的蛋白质相互作用,信号传导和蛋白质定位。
1. 蛋白质的糖基化[11, 12]
糖蛋白在细胞内部,细胞膜和细胞外均有发现,实际上大部分蛋白质是糖蛋白。对糖蛋白的检测和分析发现,糖蛋白中糖组分的结构和功能具有多样性。糖蛋白中的糖通常是不同种类的,而且是由一些可控数量的单糖组成。糖基化的多样性与细胞周期,细胞分化和发展的状态有关。在蛋白组时代中,蛋白质的修饰会引起其理化性质的改变,因此是不容忽视的。
从1D或2D凝胶得到的糖基化蛋白的识别,一般是进行MALDI-MS指纹分析,
或是对MALDI-PAD或ESI-MS/MS得到的碎片谱进行分析。对完整的糖蛋白的研究是非常困难的,所有已知的离子化技术都有其局限性。目前,人们主要研究糖肽,其好处之一就是质量减小了,这就会得到更好的分辨率,而且糖肽仍保留了糖基化位点。将分离的糖蛋白用不同的蛋白酶消化后就可进行糖肽的研究。一旦糖肽被识别出,就可以用串连质谱(ESI-MS/MS)来阐明肽序列。当蛋白的序列已知时,计算质量差就可推出其上附着的寡糖的质量。
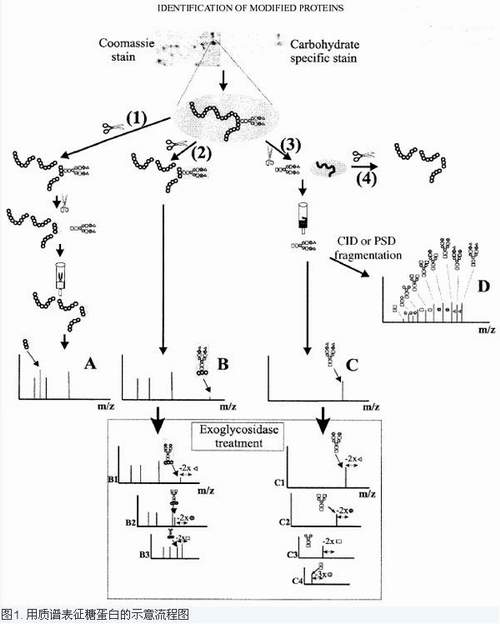
要将糖部分从糖蛋白中释放出来,可用化学切割或酶切割(流程图见图1)。目前,连有结构专一性糖苷酶的质谱在提供序列,分支和链接数据方面是最有力的技术。对于N糖基化常用的糖苷内切酶有PNGase-F,
PNGase-A,
EndoF和EndoH。化学切割也可以用来释放O-连接和N-连接的多糖,但经常出现的缺点是他会完全破坏所有的肽键,因而丢失了关于糖附着位点的信息。而且这些切割不能从糖肽中连续释放单糖。用肼的化学切割可以除去两种类型的糖基化。在60℃可专一性的释放O-连接的糖,而在95℃能释放N-连接的糖。释放O-原子更常用的方法是用碱进行β消除。通常,糖基中加入金属离子在MALDI和ESI中离子化。用MALDI-MS分析糖类的一个好的选择是将之与其他一些化合物混合,这样可以进一步提高灵敏度和分辨率。不同的质谱方法可以产生多糖的源后裂解(PSD)和碰撞诱导解离
(CID)谱,这可以给出有关糖的序列,分支及糖间的连接等信息。
2. 蛋白质的磷酸化[13, 14]
蛋白质中氨基酸的磷酸化在生命系统中起重要的作用。磷酸化经常作为分子开关控制不同过程蛋白质的活性,如新陈代谢,信号传导,细胞分裂等过程。因此,蛋白质中磷酰氨基酸的识别在蛋白质分析中是一项重要的工作。已知的磷酰氨基酸的类型有四种:
1.O-磷酸盐,通过羟氨酸的磷酸化形成的,如丝氨酸,苏氨酸,酪氨酸。
2.N-磷酸盐,通过精氨酸,赖氨酸或组氨酸中的氨基的磷酸化形成的。
3.乙酰磷酸盐,通过天冬氨酸或谷氨酸的磷酸化形成的。
4.S-磷酸酯,通过半胱氨酸的磷酸化形成的。
用质谱分析磷酸化时主要存在的问题是,混合物中磷酸化肽的信号被抑制。因此只有当一些非磷酸化肽的含量降低(或磷酸化的肽被富集)后,
分析磷酸化的肽才会变得容易些。一些相应的用于质谱分析的前磷酸化肽或磷酸化蛋白质的分离和富集方法和技术已有所发展,现已建立的分离技术有:双向磷酸多肽谱图(2D-PP),高分辨率的凝胶电泳(2DE)和反相高效液相色谱(RP-HPLC)。对于32P标记的磷酸化肽或蛋白可用放射自显影或磷储屏检测,提取后可以高灵敏度MALDI-MS分析;如果32P标记不可行,就要用LC-MS/MS分析,常用HPLC与质谱联用。
常用的富集方法有:固定金属亲和色谱(IMAC),IMAC是选择性分离和富集磷酸化肽最广泛的方法。此方法中,
键合在螯合底物上的金属离子(通常是Fe3+或Ga3+)选择性地与磷酸化肽中的磷酸部分相结合, 并且在高pH
或磷酸缓冲液中磷酸化肽可以释放出来。抗体免疫沉淀,高亲和性抗体可以从复杂混合物中免疫沉淀特定的蛋白。目前利用抗体富集蛋白/肽仅局限于分析磷酸化酪氨酸,
然后用MALDI-TOF MS分析与抗体相联接的磷酸化肽。尽管用于免疫沉淀的抗体对其底物必须有相对高的亲和力,
但低亲和力抗体仍然可以有效地用于免疫印迹Western-blotting分析。化学修饰,已建立了两种从复杂混合物中专一分离磷酸化蛋白/肽的方法[15,16]。但两种方法都有待进一步优化以鉴定低丰度蛋白质。
磷酸化肽的检测和磷酸化位点的确定主要有以下MS技术:MALDI-TOF MS
可以通过肽指纹谱(PMF)鉴定蛋白质,与磷酸酯酶处理相结合可以确定磷酸化位点。其原理是磷酸酯酶处理后,磷酸化的肽丢失磷酸基团而产生特定质量数的变化,MALDI-TOF
MS通过检测这种质量数的变化而确定磷酸化位点。串联质谱(MS/MS)
可进行前体离子扫描,这一方法是通过检测磷酸基团产生的特定片段来报告磷酸肽的存在。磷酸化肽经CID后会产生磷酸基团的特异性片段,这些特异性的片段在用串联质谱进行前体离子扫描时可作为磷酸肽的“报告离子”。串联质谱还可进行中性丢失扫描,这种方法是用MS/MS检测经CID后发生中性丢失H3PO4
(98 u)的肽段。另外,由于液相色谱分离肽降低了离子抑制效应,也有人用LC-MS/MS分析磷酸化位点。傅立叶变换质谱进行电子捕获解离
电子捕获解离(ECD)与傅立叶变换离子回旋加速共振(FTICR)质谱相连是蛋白质、肽测序和研究蛋白质翻译后修饰的一个有力方法。近来,它已被成功地用于鉴定肽片段上发生磷酸化的残基。
五、 小结
目前,生物质谱被认为是大规模、高通量进行蛋白结构鉴定的首选工具,但与之结合的2-D电泳仍有缺点,如工作量大,重现性差。因此,将对其进行改进,如分子扫描技术等。由于通过LC-MS/MS可直接鉴定蛋白混合物,因此将来有望不通过2-D
就能研究蛋白质组。当然,这还需要解决一些技术问题,其中最根本的是质谱的定量问题。生物质谱的魅力在于它能帮助我们研究蛋白-
蛋白间相互作用、翻译后修饰乃至基因表达水平的变化等。相信,随着生物质谱技术和数据采集软件技术的不断飞速发展,我们将能够获得这方面的更多信息,从而揭示出生命活的奥秘。
参考文献
[1]Timothy Palzkill, Proteomics, Kluwer Academic publishers, 2002
[2]曾嵘,夏其昌,蛋白质组,现代科学仪器,2000,5:5-9
[3]杨松成,蛋白质组学中的有机质谱,现代科学仪器,2000,5:9-15
[4]吕茂民,章金刚,生物质谱技术及其应用,生物技术通报,2001,4:38-41
[5]Ray Bakhtiar and Randall W. Nelson, Electrospray Ionization and
Matrix-Assisted Laser Desorption Ionization Mass Spectrometry, Biochemical
Pharmacology, 2000, 59: 891-905
[6]赵晓光,薛燕,刘炳玉,MALDI-TOF质谱仪关键技术及进展,仪器评价,2003,4:17-20
[7]Kris Gevaert, Joel Vandekerckhove, Protein identification methods in
proteomics, Electrophoresis, 2000, 21: 1145-1154
[8]刘晗青,郭寅龙,傅立叶变换-离子回旋共振质谱法在蛋白质分析中的应用,质谱学报,2003, 24(2): 363-369
[9] J. S. Page, C. D. Masselon and R. D. Smith, FTICR mass spectrometry for
qualitative and quantitative bioanalyses, Current opinion in Biotechnology,
2004, 15: 3-11
[10]Kris Gevaert, Joël Vandekerckhove, Protein identification methods in
proteomics, Electrophoresis, 2000, 21: 1145-1154
[11]A. Sickmann, M. Mreyen and H. E. Meyer, Identification of modified Proteins
by Mass Spectrometry, IUBMB Lift, 2002, 54: 51-57
[12]蔡耘,钱小红,生物质谱技术在糖蛋白结构分析中的应用,生物技术通讯,2002,13(5):404-407
[13]黄珍玉,于雁灵,方彩云,杨凡原,质谱鉴定磷酸化蛋白研究进展,质谱学报,2003,24(4):494-500
[14]姜颖,徐朗莱,贺福初,质谱技术解析磷酸化蛋白质组,生物化学与生物物理进展,2003,30(3):350-356
[15]Oda Y, Nagasu T , Chait BT, Enrichment Analysis of Phosphorylated Proteins
as a Too l for Probing the Phospho proteome, Nat. Biotechnol, 2001, 19: 379-382
[16] Zhou H, Watts JD, Aebersold R, A Systematic Approach to the Analysis of
Protein Phosphorylation, Nat. Biotechnol, 2001, 19: 375- 378
互联网
展源
何发
相关文章
-

液相色谱在线净化-电喷雾串联质谱应用案例
2020-09-15
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

三聚氰胺,你还要害多少人
2020-05-27
-

红外光谱分析,你了解多少?
2021-01-11
-

HPLC检测器,你了解吗?
2024-03-06
-

超净工作台原理,使用与维护
2020-05-27
-

选对色谱柱,快速开发方法
2020-05-27
-
检测有机氯类农药,气相色谱法检测法
2021-01-12

加载更多