免疫亲和-衍生-LC测Aflatoxin
免疫亲和-衍生-LC测Aflatoxin
黄曲霉毒素是黄曲霉和寄生曲霉的代谢产物,广泛存在于自然界中。最常见的黄曲霉毒素有B1、B2、G1、G2等,其中B1毒性最强,G1次之,B2、G2较弱。由于黄曲霉毒素的强毒性和强致癌性,许多国家和组织机构均规定了食品中的黄曲霉毒素的限量值。其中,欧盟规定了坚果、玉米、果脯等农作物中黄曲霉毒素B1的含量不得超过2.0~8.0μg/kg,B1、B2、G1和G2的总量不得高于4.0~15.0μg/kg。美国FDA分别规定了食物和动物饲料中的4种黄曲霉毒素的总量不得超过20μg/kg和300μg/kg。因此,建立准确、有效的黄曲霉毒素的测定方法非常重要。
由于农作物和食品中的黄曲霉毒素含量都比较低,样品基质非常复杂,免疫亲和柱净化结合柱前(后)衍生、HPLC-FLD检测的方法越来越多地应用于各种样品的分析。本文综合考虑色谱峰柱后扩散、分析速度、分离度及灵敏度,建立了免疫亲和柱净化-柱后电化学(Br2)衍生快速测定黄曲霉毒素的HPLC-FLD方法,并成功并用于玉米和花生酱中的黄曲霉毒素的分析。
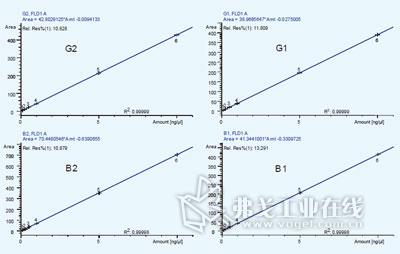
图1. 4种黄曲霉毒素的线性方程及相关系数。
实验部分
仪器及装置
Agilent 1260 Infinity液相色谱系统,包括溶剂架,四元泵(内置脱气机),标准自动进样器,柱温箱,荧光检测器。拜发公司KOBRA电化学衍生装置,包括电化学衍生池、可变控制电源、0.5mm内径PEEK管(至少34cm)等。
HPLC 方法
色谱柱:Zorbax Eclipse Plus C18,4.6mm×150mm×5μm;
柱温:40℃;
流动相A:1L水,加入238mg 溴化钾和700μl 4M硝酸;
流动相B:甲醇;
等度:A/B = 50/50,12min;
流速:1.0ml/min;
检测:荧光, Ex为362nm, Em为455nm,gain=15;
进样量:20μl;
电化学衍生池电流:100μA;反应管:0.5mm i.d×34cm PEEK管(从衍生池出口到荧光检测器入口)。
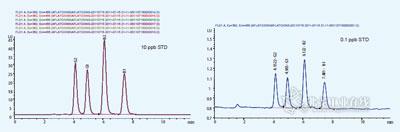
图2. 6针10μg/L 黄曲霉毒素混标连续进样色谱图(左)和0.1μg/L 混标色谱图(右)。
样品前处理方法
称取25g待测样品于高速匀质器中,加入2g氯化钠和125ml甲醇/水(60/40, V/V),高速搅拌匀质1min后,加入125ml去离子水稀释提取液。手动混合均匀后,立即取40~50ml该提取液过Whatman No.4滤纸,取滤液10ml(相当于1g样品)上样于预先活化好的AFLAPREP免疫亲和柱(活化程序参考亲和柱说明书),以2~3ml/min流速流过免疫亲和柱,再用10ml去离子水冲洗免疫亲和柱并抽至近干。精密移取1 ml甲醇于免疫亲和柱,以手动方式,用2ml注射器将甲醇缓慢推过免疫亲和柱(必要时,可用甲醇反冲免疫亲和柱以保证黄曲霉毒素完全洗脱),完全收集洗脱液,并用1ml去离子水稀释洗脱液,混匀后过0.22μm滤膜,待测。
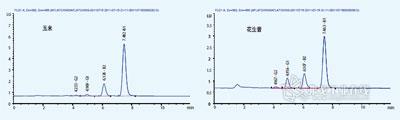
图3. 玉米样品(左)和花生酱样品(右)色谱图。
方法线性范围、检出限和精密度
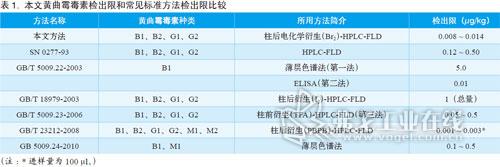
分别配制0.1、0.25、0.5、1.0、5.0、10.0μg/L 四种黄曲霉毒素B1、B2、G1、G2的混合标准溶液(稀释剂为MeOH/H2O =50/50),按上述HPLC 方法分析,以峰面积对浓度作图,得出四种黄曲霉毒素的线性拟合曲线相关系数R2>0.99998,线性拟合方程见图1。按信噪比S/N=3计算,得出B1、B2、G1和G2的检出限分别为0.007、0.004、0.006和0.005μg/L,连续6次10μg/L标准混合溶液考察方法精密度,得出4种黄曲霉毒素峰面积RSD<0.3%,保留时间RSD<0.1%。6针10μg/L标准混合溶液叠加色谱图和0.1μg/L混标色谱图如图2所示。表1 比较了本文方法和常见标准方法的检出限,发现本文方法可完全满足现行国内外标准的要求。
小结
本文通过柱后电化学衍生-荧光检测方法,进一步提高了黄曲霉毒素G1和B1的检出限。在保证4种黄曲霉毒素分离度的前提下,将黄曲霉毒素的保留时间缩短至8min之内(为保证样品组分完全洗脱,实际样品分析时间为12min)。同时为去除样品中干扰组分,采用免疫亲和柱净化样品,效果明显。实验证明,该方法可用于实际样品中痕量黄曲霉毒素的准确测定。
安捷伦科技有限公司
展源
何发
相关文章
-

免疫亲和-衍生-LC法测Aflatoxin
2020-05-27
-

免疫亲和-衍生—LC测Aflatoxin
2020-05-27
-

免疫亲和-衍生-LC法测黄曲霉毒素
2020-05-27
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-
红外光谱分析,你了解多少?
2021-01-11
-

HPLC检测器,你了解吗?
2024-03-06
-

三聚氰胺,你还要害多少人
2020-05-27
-

超净工作台原理,使用与维护
2020-05-27

加载更多