溶出度实验及测定方法验证
溶出度实验、测定方法验证
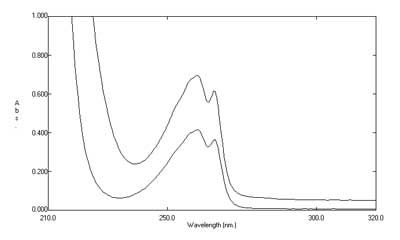
图1. 供试品溶液图谱(上)与对照品溶液图谱(下)相比,基线被整体“抬高”。
作为2009年度“溶出度专栏”的结束篇,本文介绍了溶出度实验注意事项、测定方法的验证,包括实验操作环节与测定环节。当然,关于溶出度的研究、应用还将一直持续下去。
实验操作环节注意事项
(1)有研究表明,明胶交联对于药物生物利用度的影响与交联度呈正相关,溶出介质中加入适量的酶可以有效评价交联胶囊的溶出度。因此,对于此类产品,应予以相应验证后在质量标准中明确注明是否需在溶出介质中添加酶以及酶的种类与浓度,并应有体内外相关性研究。
(2)自动取样装置由于存在管道吸附和滤膜吸附,故应注意验证其和手动取样获得的数据间有无显著性差异。
(3)采用转篮法试验时,应注意转篮的洁净程度,一般在阳光下观察转篮的空隙是否有堵塞。如有,可采用超声或在稀硝酸中煮沸、再在水中煮沸的办法进行处理。
(4)溶液取出后需进行过滤,过滤的主要目的是为阻断颗粒继续溶出和排除其后测定的干扰。滤器一般需用介质预湿润,过滤时应注意要确保滤膜吸附饱和后再取续滤液,故应验证达到饱和时的初滤液体积量,一般应不超过5~10ml。滤膜吸附量在2%以内可忽略不计。
曾发现难溶性药物的小规格制剂,一般均需要较为大量初滤液情况,该因难溶性药物皆进行了微粉化处理,比表面能增大,而滤膜吸附量为固定值,故需大量初滤液方能至饱和。
此时,建议采用“溶液取出后勿过滤、直接离心取上清液进行测定”的方法进行验证。对于离心可加速未溶颗粒的进一步溶出,从而人为地增加溶出量的担心,其实大可不必。因为采用离心,取样量2ml即可(此类制剂一般均采用HPLC法测定),在取样位置处存在未溶颗粒和恰好被抽取的概率应该说是几乎不存在的,所以这点顾虑完全是多余的,拟定采用离心方式的质量标准已有很多。
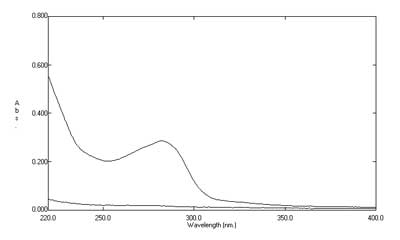
图2. 辅料呈一“斜坡形”吸收(下)。
测定方法验证
溶出度检测方法除按照既定的方法学认证各项要求进行之外,尚需注意以下事项:
(1)对于某些难溶性药物,如难以采用溶出介质直接溶解对照品,可先加少量有机溶剂(如甲醇或乙醇)溶解后,再加溶出介质稀释的办法。如最终溶液中有机相比例不超过2%,则无论采用何法测定,皆无需验证,直接使用即可;如超出2%,则应予以相应验证。
验证方法:取原料药粉末,一种方法采用甲醇溶解后用溶出介质稀释方式;另一种采用置1000ml量瓶中,加900ml溶出介质,置37℃水浴中加热使溶解后,再加溶出介质稀释至刻度,摇匀,再稀释至与前者相同浓度,测定响应值,在98.0%~102.0%间即证明前者所含的有机相对测定无干扰。
(2)线性范围应考虑到有可能出现的低浓度点情况,如对于溶出曲线或缓/控释制剂的测定等。并为减小外标一点法的测定误差,建议将对照品溶液配制为约50%释放量浓度。
(3)应注意考察活性成分在37℃溶出介质中的稳定性。若不佳,应在质量标准中标注“取出后立即测定”字样;不建议在溶出介质中加入抗氧剂、稳定剂,以及取出后对溶出液采用繁琐的稳定措施。
(4)根据实际情况,检测波长可选取非最大吸收波长甚至末端吸收。
(5)当测定法为紫外法时,由于易受辅料或胶囊壳的影响,建议分别取对照品溶液与供试品溶液进行紫外扫描后根据所得图谱予以明了,亦可采用高效液相法进行佐证。如干扰存在,可考虑采用双波长相减法或空白胶囊壳扣除法等方法予以消除,不建议采用紫外导数光谱法;如干扰排除较为困难,建议采用高效液相色谱法测定。
(6)空白胶囊壳干扰在2%以内可忽略不计,若大于2%,则应重新选择测定法。空白胶囊壳的测定,建议取6粒样品,彻底清除其中内容物,同法试验和过滤后,分别量取相同体积混匀测定。测定时以相应溶剂为空白。
(7)不应出现溶出度测定结果均值高于含量测定结果3%以上的情况。如出现,应重新考察溶出度测定方法的适用性。
(8)对于小规格制剂,不建议采用大于1cm的吸收池进行紫外法测定,而建议采用HPLC法(并可酌情加大进样量以提高测定精密度)。但对于具有较强紫外吸收的活性药物,为提高工作效率,可考虑采用0.1~1.0cm短吸收池,但必须经过验证。
(9)紫外测定时典型干扰图谱
第一种情况,辅料干扰呈“一条平行线”(如图1),此时可考虑采用两点法相减。第一点为最大吸收波长、第二点为远端基线处(如此例中可选择310nm)。第二种情况,辅料干扰呈“一条斜坡形” (如图2),此时则应改为HPLC法。
溶出度常见问题问答
谢老师一直在致力于溶出度技术的推广、交流,除了为本刊主笔“溶出度专栏”外,还于2008年11月开始在某网站开辟“溶出度研究”专版,与网友在线互动,畅谈溶出度测定相关问题,令众多网友受益匪浅,以下是谢老师精选的部分网友在线问答。
Q:试验时6份样品需要准备6个过滤装置吗?
A:不需要,一个过滤头,一个针筒,一个取样针即可。第一份弃去一定体积初滤液使滤膜吸附饱和后,其后样品则无需再弃去初滤液,取滤液测定皆可。
Q:多条溶出曲线测定的重要性已不言而喻,但是工作量巨大,如何高效便捷地完成测定呢?
A:在测定方法上强烈推荐采用高效液相色谱法。因为溶出曲线上的高低各点响应值差异很大,如采用紫外法,为满足吸收度值在0.25~0.85间的检测需要,或采用稀释法或采用长距离吸收测定池,同时,考虑到辅料/胶囊壳等的干扰,因此不推荐采用紫外法测定。
采用HPLC法,由于线性范围宽、溶液取出后无需稀释即可立即进样;每次可量取1ml,采用液相用滤头过滤,取滤液测定即可(按照第一个问题的回答,第一份样品取2ml);如此,由于取样体积小、还可省略去测得溶出量的校正计算。同时,为提高测定效率,一者可采用现今越来越普及的超高速液相,几十秒钟即可测定一针;或采用增加原有流动相中有机相比例、升高柱温等措施,使保留时间缩短。
甚至对于一些小规格制剂,由于取样1ml中所含辅料的可能性极小,可采取勿过滤、直接置于液相小瓶中放置一段时间后,进样亦可(本人曾多次如此操作,效果良好,但此法不适应于超高速液相)。
Q:请阐述一下漏槽条件对于溶出度试验的意义。
A:漏漕条件的定义为:溶出介质体积要大于溶解药物主成分(该量为制剂最大规格量)所需体积的至少3倍量,以保证药物溶出不受其溶解性的显著影响。该理念的推出,是美国学者在最初建立溶出度试验方法时,斟酌确定溶出杯体积时所推出的一个概念,从当时所研究的药物出发,针对该理念,1000ml的溶出杯可基本满足大部分药物。
现今,由于溶出介质体积已固定,通常选用900~1000ml。以此为出发点,如根据某药物在某溶出介质中的溶解度值来推算采用“何种溶出介质”或“添加多少浓度的表面活性剂”,将完全无视“药物制剂”的作用,将“药剂可以改善药物的水难溶性”这一至关重要的理念完全摈弃了,所以,该理念在现今溶出度试验应用中已基本无用武之地。
Q:主成分边溶出边有一部分(如20%)转变成另一物质,取出后应如何测定评价呢?
A:遇到此种情况,建议溶液取出后,采取某种处理手段使主成分全部定向转变后测定该“转变物”,采用UV法和HPLC法测定均可。
Q:绘制溶出曲线时,最终溶出量一定要达到100%释放量吗?
A:不必如此。某种情况下,溶出度释放会出现饱和,呈现一“平台期”,只要连续两点溶出率达90%以上(缓/控释制剂为85%),且差值在5%以内时,试验则可结束,没必要追求至100%溶出量。
Q:配制含有表面活性剂(十二烷基硫酸钠或吐温-80)的溶出介质时,为何配置后放置一段时间会析出,导致无法测定?
A:配制含有表面活性剂的溶出介质时,建议将表面活性剂加入水相中,并加入沸石或玻璃珠,置电炉或直火上加热,并不时采用长玻璃棒搅拌促进其溶解,待液体变得逐渐澄清即将沸腾时,带上手套迅即移离加热源,待冷去后使用即可。这样放置几天均不会析出。之所以析出,因为采用的是超声等较弱方式溶解,故不建议如此。
Q:有无方便易行查询“药物渗透性”的网站?
A:美国口服药物传递研究公司(Therapeutic Systems Research Laboratories Inc,简称TSRL公司)在该公司网站提供了免费查询系统,网址为:
http://www.tsrlinc.com/services/bcs/index.htm,其中还可查询该药物的其他物理化学参数。同时、该网站还有有关BCS分类系统的详尽阐述,可供参阅。
《实验与分析》
展源
何发
相关文章
-

化学药品溶出度方法研究
2020-05-27
-

溶出度技术的应用
2020-05-27
-

关于溶出度技术的应用
2020-05-27
-

溶出度试验质量标准制订
2020-05-27
-

化学药品溶出度方法实验研究初探
2020-05-27
-

溶出度实验、测定方法验证
2020-05-27
-

溶出度试验质量标准的制订
2020-05-27
-

溶出度技术在制剂上的应用
2020-05-27
-

生物药剂学分类系统与溶出度试验
2020-05-27

加载更多