如何选择无细胞蛋白表达系统
无细胞蛋白表达系统的选择
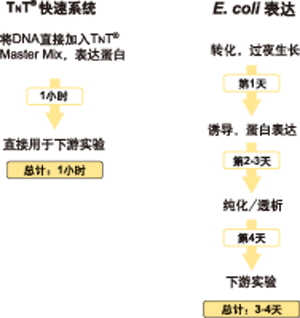
图1. 与细胞内蛋白表达相比,无细胞蛋白表达系统能够显著地节约时间。
与基于细胞的蛋白表达系统相比较,无细胞蛋白表达系统具有独特的优势,包括节约时间、提高具有功能的、可溶的、全长蛋白的总体产量。本文介绍了根据模板类型、期望产率以及下游实验等因素来选择无细胞蛋白表达系统的标准。
与基于细胞的蛋白表达系统相比较,无细胞蛋白表达系统具有独特的优势,包括节约时间、提高具有功能的、可溶的、全长蛋白的总体产量。此外,无细胞蛋白表达系统更适用于激酶等毒性蛋白的表达、也可使用经过修饰的tRNA来进行标记,在某特定位点掺入非天然的氨基酸。同时,这些系统还可以用于高通量实验。选择一个无细胞蛋白表达系统,最主要的几点考虑因素包括细胞提取物或裂解物的来源、模板以及期望的蛋白产量。本文介绍的信息可帮助研究者选择适合其实验体系和下游应用的无细胞蛋白表达系统。
考虑因素之模板
在使用插入片断或载体进行真核细胞系统蛋白表达时,有以下几个因素需要考虑:(i)ATG起始密码子应该是位于转录起始位点下游的第一个ATG密码子;(ii)理想化而言,在启动子之后,ATG应该包含在Kozak共有序列之内;(iii)在模板序列的3'端应包含终止密码子;(iv)终止密码子之后应带有合成的多聚A尾。此外,使用TNT T7麦胚偶联系统(TNT T7 CoupledWheat Germ System)时,载体还应包含一个T7终止子序列或该载体呈线性化。在原核系统中,起始密码子的选择几乎无一例外地依赖于核糖体结合位点(ribosomal binding site, RBS)的存在,这个位点包含了阅读框架的起始信号。经过优化的核糖体结合位点能够大大提高原核细胞内蛋白的表达。原核系统不识别位于ATG起始密码子上游的任何ATG,除非这些ATG含有一个处于合适位置的核糖体结合位点。使用兔网织红细胞裂解物(RABBit ReticulocyteLysate, RRL)时,DNA介导的蛋白合成与mRNA为起始的蛋白合成相比较,具有以下优点:当进行高水平的蛋白合成时,不需要处理mRNA的繁杂操作过程。

图2. TNT兔网织红细胞裂解物转录/翻译偶联系统以质粒为模板,在一个试管内完成转录和翻译;TNT PCR DNA快速系统对于PCR模板效果良好。
基于真核细胞RNA的翻译
在1950至1960年间,研究人员证实了兔网织红细胞裂解物可以经过人为操作,用于外源mRNA介导的蛋白合成,这样可以只把感兴趣的蛋白合成出来。经过核酸酶处理的兔网织红细胞裂解物和Flexi兔网织红细胞裂解物均增加了一些添加剂,为mRNA的翻译过程进行了优化。这些添加剂包括氯高铁血红素—用于防止亚铁血红素调节的elF-2α激酶(HRI)的激活作用;能量生成系统,含有经过测试的磷酸肌酸激酶和磷酸肌酸;以及小牛肝脏tRNA用于平衡消耗的tRNA种类,这样可以优化密码子的使用,并扩大可被高效率翻译的mRNA的范围。与经过核酸酶处理的兔网织红细胞裂解物相比较,Flexi兔网织红细胞裂解物系统可提供更强的灵活性,能够将翻译反应的很多参数进行优化,这些参数包括Mg2+浓度、K+浓度,以及DTT的存在与否。
麦胚提取物(Wheat Germ Extract, WGE)含有合成蛋白所需要的细胞组分(tRNA、核糖体、起始因子、延长因子以及终止因子)。该提取物系统做了进一步优化:添加了由磷酸肌酸和磷酸肌酸激酶组成的能量生成系统;添加了亚精胺,用于加强蛋白链延长的效率,以防止蛋白链的终止过早地发生;添加了醋酸镁,并使其浓度适合大多数种系mRNA的翻译。
最后,还单独提供了醋酸钾,以用于优化更多种类的mRNA。
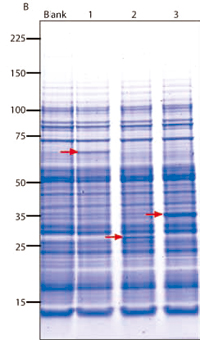
图3. Coomassie染色的SDS PAGE。使用TNT SP6 高产率提取物系统以透析模式表达蛋白,反应体系为100μl,质粒模板8μg,提取物60μl。反应体系置于透析杯(MWCO 12000 BioTec International, 经销-DaiichiPure Chemicals DBC Code 212956)内,Uniplate(Whatman)中含有2.5ml透析缓冲液,于25℃孵育18h。透析缓冲液含有12 mM HEPES、0.5mM亚精胺、5 mM DTT、80μM氨基酸、70mM KOAc、1.7mMATP、0.6mM GTP、0.6mM CTP、6 mM UTP、20mM CP和3.5mMMg(OAc)2。泳道1:萤火虫萤光素酶,MW 62 KDa;泳道2:MonsterGreen GFP,MW 28 KDa;泳道3:人源化的海肾萤光素酶,MW 36KDa。
麦胚提取物适用于表达小分子的蛋白,或用于表达富含于兔网织红细胞裂解物中的蛋白。当RNA制备物中含有少量的dsRNA或硫醇时,该系统也很适用,上述这些物质具有抑制翻译的作用。在表达植物蛋白、酵母蛋白或其它真菌蛋白时,研究人员也会发现麦胚提取物比兔网织红细胞裂解物更合适。
基于真核细胞DNA的转录和翻译
20世纪90年代,偶联的转录/翻译(即TNT)系统被开发出来,该系统包含兔网织红细胞裂解物或麦胚提取物,并带有T7、T3或SP6 RNA聚合酶,这些系统使基于DNA的蛋白合成成为现实。TNT兔网织红细胞裂解物转录/翻译偶联系统和TNT快速转录/翻译偶联系统仅需一个试管,即能够以质粒为模板转录和翻译蛋白(图2)。常规的TNT偶联系统中的不同组分以单独包装提供,包括三种氨基酸混合物:甲硫氨酸缺失的混合物、半胱氨酸缺失的混合物或亮氨酸缺失的混合物。TNT快速偶联系统提供一个混合母液,包含所有的反应组分(包括甲硫氨酸缺失的氨基酸混合物),减少了加样步骤,节约了时间。TNT T7 PCR DNA快速系统是为PCR反应产生的线性DNA模板而特别设计,这样的模板比质粒DNA模板往往要求更高的钾离子和镁离子浓度。
对于真核细胞转录/翻译偶联反应,除兔网织红细胞裂解物之外,TNT麦胚提取物系统(TNT CoupledWheat Germ Extract Systems)是又一个选择,后者也是单个试管的反应模式。普通的麦胚提取物通常是利用SP6, T3或T7 RNA聚合酶启动子在体外合成RNA,然后再进行翻译反应。与此不同的是,TNT麦胚提取物系统将转录反应直接整合到翻译反应混合物中。
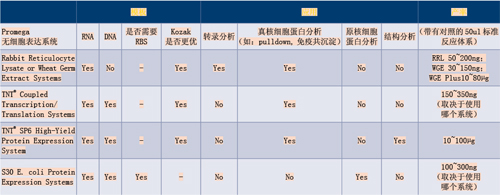
Promega无细胞表达系统比较表:模板、应用及产率模板应用产率
基于原核细胞DNA的转录和翻译
E.coli S30提取物系统(E.coli S30 ExtractSystems)是从E.col i B菌株制备而来,该菌株中omp T 胞内蛋白酶和lon蛋白酶活性缺失。这种缺失能够大大提高被表达蛋白的稳定性,否则,在细胞内表达的蛋白会被蛋白酶所降解。E.coli S30提取物系统能够表达更多量的蛋白,这些蛋白在细胞内表达时,由于宿主编码的抑制剂的激活,这些蛋白的表达量很低。E. coli S30提取物的DNA模板可以是线性的,也可以是环状的。线性DNA为模板的S30提取物(E.coli S30 Extract System for Linear Templates,Cat.# L1030)是从E.coli B菌株中制备的,该菌株核酸外切酶V(recBCD enzyme)缺失。以线性DNA为模板的S30提取物比以环状DNA为模板的S30提取物(E.coli S30 Extract System for Circular DNA, Cat.#L1020)和T7 S30提取物(E. coli T7 S30 Extract System for Circular DNA, Cat.# L1130)的活性低。在使用这些系统时,研究人员仅需准备带有适当的原核细胞启动子和核糖体结合位点的克隆DNA即可。
以环状DNA为模板的E. coli T7 S30提取物系统(Cat.# L1130)简化了克隆在质粒或Lambda载体上的DNA序列的转录/翻译反应,该提取物中包含用于转录的T7 RNA聚合酶,以及翻译反应所需的所有必备组分。研究人员仅需提供带有T7启动子和核糖体结合位点的克隆DNA。
考虑因素之蛋白产量
对于大多数体外表达系统而言,每50ml反应体系可产生皮摩尔级或纳克级的蛋白量。通常,该产量足够用于大多数的蛋白放射性分析、荧光分析以及抗体分析,例如聚丙烯酰胺凝胶分离、Western blotting、免疫沉淀;或者,也可进行酶学或生物活性的检测,这取决于目的蛋白的特性。如果是放射性检测,应在翻译反应体系中加入同位素标记的氨基酸,翻译反应结束后,可使用SDS-聚丙烯酰胺凝胶电泳(SDSPAGE)结合放射性自显影来检测目的蛋白。或者,也可使用非放射性标记方法,如荧光法、化学发光法或比色法。
如果拥有现成的目的蛋白的抗体,也可以使用免疫杂交或免疫沉淀的方法来进行检测。通常,从体外翻译反应得到的蛋白,其功能活性可在翻译反应混合物中直接进行检测。如果有必要纯化蛋白,可将目的蛋白与纯化标签融合,使目的蛋白便于从体外翻译反应体系中纯化出来,然后可进行进一步研究。
高产率的无细胞蛋白合成
如前所述,大多数无细胞表达系统所产生的蛋白量是有限的。用于表达真核细胞蛋白的麦胚提取物经过进一步修饰,能够提高蛋白表达量,可用于多种功能和结构蛋白质组学研究。SP6 TNT高产率系统(TNT SP6 High-Yield Wheat Germ Protein ExpressionSystem, Cat.# L3260, L3261)使用高产率提取物,补充了SP6 RNA聚合酶以及其它组分。分批模式下,该系统可合成的蛋白量是100 mg/ml,使用透析模式时,可得到200~400mg/ml的蛋白(图3)。此外,可不经过蛋白纯化,即可在反应体系内直接进行酶活性的检测。通过亲和标签,可完成简便的纯化,仅需一步即告完成。也可经过微小的修改,在该体系内实现对目的蛋白的标记。
总结
无细胞表达系统能够帮助你完成蛋白的快速表达,产量足够用于下游实验。与细胞内表达相比,这些系统对毒蛋白的敏感度低;结合应用某些附加组分,如微粒体膜,可表达正确折叠的蛋白以及经过修饰的膜蛋白;同时,这些系统还可以在目的蛋白上掺入标记物或用于纯化的标签。
《实验与分析》
展源
何发
相关文章
-
无细胞蛋白表达系统的选择
2020-05-27
-
如何研究细胞关键蛋白
2020-05-27
-

自动化的细胞筛选系统
2021-02-22
-

重组蛋白高产量的瞬时表达
2020-05-27
-

重组蛋白的高产量瞬时表达
2020-05-27
-

氘灯更换Tips,一般人我不告诉他!
2020-05-27
-

选对色谱柱,快速开发方法
2020-05-27
-

光诱导荧光蛋白系统
2020-05-27
-

细胞总乙酰化水平的快速测定方法
2021-01-11

加载更多