ICH Q3D的更新与药品生产风险评估
2018年1月1日起,元素杂质标准变更对化药的检测尤为重要。药品中的金属污染(元素杂质)来源多样,既可能是在合成过程中添加,也可能以污染物形式存在(例如通过与加工设备的相互作用或存在于药品的组分中),因而可在药品中检测到。由于元素杂质具有一定的毒理作用,会对患者健康造成危害,因此,药品中的元素杂质水平应控制在可接受限度内。
自2017年7月份中国加入ICH成员国后,我国的制药行业也开始参照ICH的国际标准。通过加入ICH,更好地加强国际交流和合作,助力我国的药品审评审批制度改革,更好地推动药物研发创新。这也是基于近年来国家食药总局积极参与ICH活动和相关国际标准的制修订,已转化和借鉴了ICH二十余部技术指南应用于我国的药品技术审评。
ICH Q3D指南的更新
2009年,人用药品注册技术要求国际协调会(ICH)提出制定一项新的全球协调指南,以限制药品和原料中金属杂质的含量。该方案可在全球范围内为元素杂质规格限值提供合理的监管指导,有望对国家监管机构的工作产生影响,确保结果的透明性和比较性。
在Step 4 版《元素杂质指南》中,ICH将元素杂质分为四类,以推动风险评估过程中的决策制定:
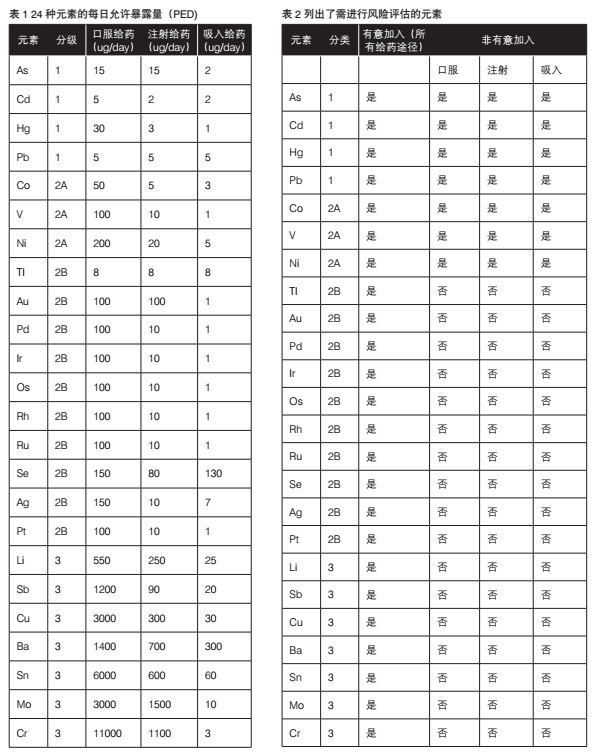
1类:该类杂质对人类毒性明显,在药物生产过程中一般限制 或禁止使用;它们通常存在于常用材料中(例如赋形剂)。以下这四种元素,要求根据所有可能的元素杂质来源和给药途径进行风险评估。元素包括:砷、镉、汞、铅。
2类:该类对人体有毒杂质的毒性大小取决于药物制剂给药途 径。基于它们在药品中出现的相对可能性,其被进一步分为2A和2B。
2A类元素在药品中出现的概率相对较高,因此需要对所有 可能的元素杂质来源和给药途径进行风险评估(如表所示)。2A类元素包括:钴、镍和钒。
2B类元素因为浓度较低,且与其他物质分离的可能性较低, 因此在药品中出现的概率相对较低。除非在制造原料药、赋形剂或药品的其他组分时有意加入,否则无需进行风险评估。2B类元素包括:银、金、铱、锇、钯、铂、铑、钌、硒和铊。
3类:通过口服给药时,该类元素杂质毒性相对较低,但如果通 过吸入或注射途径给药,则需进行风险评估。元素包括:钡、铬、铜、锂、钼、锑和锡。
其他元素:由于其毒性低,或区域法规不同,部分元素的元素 杂质允许日接触量(PDE)标准尚未建立。如果药物产品中含有该类元素杂质,则须通过其他指南,或区域性法规进行处理。这些元素包括:铝、硼、钙、铁、钾、镁、锰、钠、钨和锌。
USP和EP评估
截至2010年,USP和EP有关药物重金属污染的数据,均是通过基于样品中金属硫化物沉淀的比色分析方法,并将其与铅标准品进行比较(USP<231>和欧洲药典2.4.8)而获得的。
根据2010年人用药品注册技术要求国际协调会(ICH)发布 的《元素杂质指南》(Q3D),USP制定了三章全新的通论,其内容涵盖杂质限度、药物产品和原料分析方法以及膳食补充剂中的元素污染物。
章节USP<232>,Ph.Eur. 5.20:药品中的元素杂质—限度
章节USP<233>:药品中的元素杂质—分析方法
章节USP<2232>:膳食补充剂中的元素污染物
2015年1月,USP决定于2018年1月1日实施通论<232>、<233>和<2232>。该通论的实施应与其他制药和医疗机构制定的限度和时间表保持一致,例如2014年12月16日发布的ICH Q3D Step 4《元素杂质指南》。
欧洲药典于2014年7月公布了关于元素杂质和ICH Q3D实施的计划。大约一年后的2015年4月,发布了其关于元素杂质以及修订通用和个别文本时间表所做的决策。并于同年8月, 对ICH Q3D范围以外的产品进行了说明。指南合规性要求将于2016年6月开始执行,针对获得新上市许可的产品,或包含新活性物质或经批准物质的产品。已上市产品(包括已批准产品的新互认申报)应符合2017年12月的指南要求。依照ICH原则,实施通用检测5.20和通用方法2.4.20,以替代有关金属催化剂和金属试剂残留量限度规定的EMA指南。该内容发表于欧洲药典9.3增补版中(实施日期为2018年1月1日),并只对天然来源的物质进行元素杂质检测。由于这些物质中所含元素杂质的特有性质,因此一直被视为制药产品中元素污染的主要潜在来源之一。此外,欧洲药典委员会还特别建议针对各论中未确立PDE标准的元素,即ICH Q3D指南中定义为“其他元素”的元素进行各种检测。

分析方法
ICH Q3D新的分析方法中未包含任何关于仪器方法的建议, 但根据产品或组分中元素杂质的预期浓度,USP<233>中提 出了以下分析方法:
百万分之一(ppm)浓度 ICP-OES或原子吸收
十亿分之一(ppb)浓度 ICP-MS测定
ICH Q3D规定的元素杂质限值
ICH Q3D规定了24种元素的毒性限值,并将其指定为四种主要给药途径的最大PDE(mg/天)。表1列出了以μg/天为单位的PDE值—仅适用于摄入量≤10g/天的药品。表2列出了需要进行风险评估的元素。
根据新编订的USP<232>和欧洲药典9.3增补版章节的要 求,我们可提供三种TraceCERT®元素混合液,其元素比例均符合ICH Q3D指南所规定的口服给药浓度;其中混合液I涵盖1、2A和部分2B类元素;混合液II涵盖其余2B类元素;混合液III涵盖所有3类元素。
本文作者来自(1 MilliporeSigma;2默克化工技术(上海)有限公司)。
展源
何发
相关文章
-

ICH Q3C残留溶剂新动向抢先了解
2021-05-21
-

ICH发布针对连续生产的最终 Q13 指南 ,如何解读?
2022-12-21
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

药品生产中的重要挑战与应对策略
2024-01-10
-

HPLC检测器,你了解吗?
2024-03-06
-
红外光谱分析,你了解多少?
2021-01-11
-

三聚氰胺,你还要害多少人
2020-05-27
-

超净工作台原理,使用与维护
2020-05-27

加载更多